Endokannabinoidy działające poprzez receptory CB1 (CB1R) odgrywają kluczową rolę w regulacji homeostazy energetycznej, co stanowiło podstawę do opracowania farmaceutycznego antagonistów CB1R w leczeniu otyłości. Pomimo skuteczności pierwszego w swojej klasie antagonisty CB1R, rimonabantu, w łagodzeniu otyłości i jej wielokrotnych powikłań kardiometabolicznych, został on wycofany z użycia klinicznego ze względu na działania niepożądane neurofizjatryczne ośrodkowego układu nerwowego, co zatrzymało dalszy rozwój terapeutyczny tej klasy związków. W porównaniu do mózgu receptory CB1R są wyrażane na niskim, ale funkcjonalnym poziomie w narządach obwodowych zaangażowanych w regulację homeostazy energetycznej, takich jak wątroba, mięśnie szkieletowe, tkanka tłuszczowa i trzustka. W ostatnich badaniach przedklinicznych selektywne ukierunkowanie tych receptorów przez „antagonisty CB1R drugiej generacji” o ograniczonym oddziaływaniu na ośrodkowy układ nerwowy replikowało korzyści metaboliczne rimonabantu w modelach myszy otyłych i chorych na cukrzycę, bez wywoływania efektów ubocznych związanych z ośrodkowym układem nerwowym. Zwiększona aktywność CB1R przyczynia się także do złożonych, wieloczynnikowych zaburzeń, takich jak różne formy zwłóknienia tkanek, leczenie których może korzystać z jednoczesnego zaangażowania więcej niż jednego celu terapeutycznego. W związku z tym nowe „antagonisty CB1R trzeciej generacji” stanowiące hybrydowe inhibitory CB1R i indukowalnej syntazy tlenku azotu zostały przetestowane w modelach myszy z marskością wątroby i płuc, gdzie ich skuteczność przeciwfibrotyczna okazała się większa niż skuteczność leków hamujących tylko jeden z tych celów. W tej recenzji omówimy wyzwania i możliwości, jakie stwarzają antagonisty CB1R drugiej i trzeciej generacji, oraz ich potencjalne zastosowania terapeutyczne.
Odkrycie receptorów kannabinoidów sprzężonych z białkami G i ich endogennych ligandów we wczesnych latach 90. XX wieku doprowadziło do gwałtownego wzrostu informacji na temat ich roli w różnych fizjopatologiach i, co za tym idzie, jako potencjalnych celów farmakoterapeutycznych. Rola endokannabinoidów działających poprzez hipotalamiczne receptory kannabinoidowe typu 1 (CB1R) jako czynników pobudzających apetyt, oreksyjnych (Di Marzo et al., 2001), była podstawą do opracowania farmaceutycznego antagonistów CB1R w leczeniu otyłości i jej powikłań metabolicznych. W kilku wieloośrodkowych badaniach klinicznych III fazy, pierwszy w swojej klasie antagonist/inwersyjny agonista CB1R, rimonabant, nie tylko spowodował utratę wagi u osób z zespołem metabolicznym, ale także istotnie poprawił liczne parametry kardiometaboliczne zmienione w otyłości, takie jak obwód talii, hemoglobina A1c, HDL, cholesterol i triglicerydy w osoczu (Despres et al., 2005; Van Gaal et al., 2008). W tym samym czasie prowadzono wiele badań klinicznych nad antagonistami CB1R (taranabant, otenabant, ibipinabant) (Tabela 1). Pomimo zatwierdzenia rimonabantu do użytku klinicznego w około 40 krajach, niepożądane efekty neuropsychiatryczne ośrodkowego układu nerwowego, takie jak lęk i zwiększona skłonność samobójcza (Christensen et al., 2007), spowodowały jego wycofanie z rynku w 2008 roku. To zatrzymało dalszy rozwój farmaceutyczny całej tej klasy związków (Tabela 1) oraz przerwało rozwój badań związanych z receptorami CB1R (Rysunek 1).
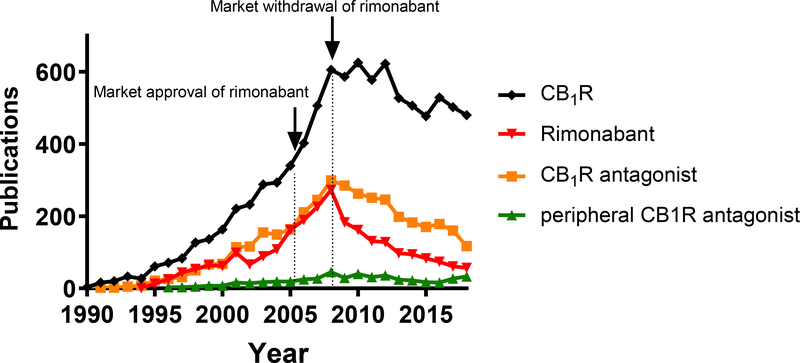
Rysunek 1. Skutki wycofania rimonabantu z rynku dla badań związanych z receptorem CB1R.
źródło: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8605822/