Układ sercowo-naczyniowy wydaje się być celem terapeutycznym dla kannabidiolu (CBD), co wynika z kilku obszarów badań:
- Efekty na Naczynia Krwionośne:
- CBD wykazuje zdolność do bezpośredniego rozszerzania naczyń krwionośnych, zarówno ostrych, jak i czasowych, co może wpływać korzystnie na przepływ krwi.
- W warunkach laboratoryjnych CBD poprawia zdolność naczyń do rozszerzania się w odpowiedzi na bodźce zależne od śródbłonka, co może być korzystne w przypadku dysfunkcji śródbłonka.
- Wpływ na Ciśnienie Krwi i Rytm Serca:
- Leczenie CBD nie wydaje się wpływać na spoczynkowe ciśnienie krwi ani częstość akcji serca, co sugeruje, że może być stosunkowo bezpieczne w tym kontekście.
- Ochrona Przed Stresem Sercowo-Naczyniowym:
- CBD redukuje odpowiedzi układu sercowo-naczyniowego na różne rodzaje stresu, co może pomóc w ochronie serca w sytuacjach stresowych.
- Ochrona Przed Uszkodzeniami Serca:
- CBD wykazuje ochronne działanie w przypadku niedokrwienia i reperfuzji serca, a także w przypadku dysfunkcji serca związanego z cukrzycą, co sugeruje potencjalne zastosowanie w leczeniu tych schorzeń.
- Ochrona Przed Uszkodzeniami Mózgu:
- CBD może także chronić przed uszkodzeniami w przypadku udaru mózgu, poprzez utrzymanie przepływu krwi i redukcję przepuszczalności bariery krew-mózg.
- Redukcja Zmian Związanych z Cukrzycą:
- CBD wydaje się redukować szkodliwe zmiany związane z cukrzycą, takie jak zwiększona przepuszczalność naczyń krwionośnych.
Badania te sugerują, że CBD może mieć pozytywny wpływ na układ sercowo-naczyniowy poprzez różnorodne mechanizmy, w tym poprawę funkcji naczyń krwionośnych, ochronę przed stresem i uszkodzeniami, a także redukcję negatywnych efektów związanego z cukrzycą.
Kannabidiol (CBD) wykazuje korzystne efekty w zakresie różnorodnych schorzeń, takich jak cukrzyca, choroba Huntingtona, nowotwory i wrzody jelita grubego. Narastające dowody sugerują również, że CBD jest korzystny dla układu sercowo-naczyniowego. CBD wywiera bezpośrednie działania na izolowane tętnice, powodując zarówno ostre, jak i czasowo zależne rozszerzenie naczyń. Inkubacja in vitro z CBD wzmacnia odpowiedzi rozszerzające naczynia w modelach zwierzęcych z upośledzonym naczyniowym rozszerzaniem zależnym od śródbłonka. CBD chroni przed uszkodzeniem naczyniowym wywołanym przez środowisko o wysokiej zawartości glukozy, stan zapalny lub indukowanie cukrzycy typu 2 u zwierząt, a także redukuje nadmierną przepuszczalność naczyniową związaną z takimi środowiskami. Powszechnym motywem w tych badaniach jest przeciwzapalne i przeciutleniające działanie CBD. W sercu, leczenie CBD in vivo chroni przed uszkodzeniem przez niedokrwienie-reperfuzję i przed kardiomiopatią związaną z cukrzycą. Podobnie, w innym modelu niedokrwienia-reperfuzji, CBD wykazuje zdolność do zmniejszania rozmiaru zawału i zwiększania przepływu krwi w modelach zwierzęcych udaru, czułych na antagonizm receptora 5HT1A. Chociaż ostre lub chroniczne leczenie CBD wydaje się mieć niewielki wpływ na hemodynamikę, CBD redukuje odpowiedź sercowo-naczyniową na modele stresu, zastosowane zarówno ogólnoustrojowo, jak i do mózgu, zahamowane przez antagonistę receptora 5HT1A. W krwi CBD wpływa na przeżycie i śmierć białych krwinek, migrację białych krwinek i agregację płytek krwi. Podsumowując, te dane przedkliniczne zdają się potwierdzać pozytywną rolę leczenia CBD dla serca oraz dla naczyń obwodowych i mózgowych.
Kannabidiol (CBD) to obfity, niepsychoaktywny, pochodzący z rośliny kannabinoid (fitokannabinoid), którego stereochemia została po raz pierwszy opisana w 1963 roku przez Mechoulama i jego kolegów [1]. Izolacja struktury chemicznej CBD ujawniła, że jest to klasyczny kannabinoid blisko spokrewniony z kannabinolem i Δ−9-tetrahydrokannabinolem (THC). Od czasu jego izolacji opracowano szereg analogów syntetycznych opartych na klasycznej strukturze dibenzopyranu kannabinoidów, w tym nietypowego CBD (Abn-CBD), O-1918 i O-1602 [2, 3]. CBD ma różnorodną farmakologię, która została szczegółowo omówiona w innych miejscach [4]. W skrócie, CBD wykazuje antagonizm wobec klasycznych receptorów kannabinoidowych 1 (CB1) i 2 (CB2) w zakresie niskich nanomoli, ale wykazuje działania agonistyczne/inwersyjne agonisty w stężeniach mikromolowych. Inne miejsca receptorowe zaangażowane w działanie CBD obejmują sieroce receptory sprzężone z białkiem G GPR55, putatywny receptor Abn-CBD, receptor transient receptor potential vanilloid 1 (TRPV1), receptory α1-adrenergiczne, receptory opioidowe µ i receptory 5HT1A [4]. Wykazano również, że CBD aktywuje i wywołuje odpowiedzi fizjologiczne za pośrednictwem receptora gamma aktywowanego przez proliferatory peroksysomów (PPARγ) [5–7]. Oprócz bogatej farmakologii, sugeruje się, że CBD ma potencjał terapeutyczny w szerokim zakresie zaburzeń, w tym stanów zapalnych, stresu oksydacyjnego, nowotworów, cukrzycy, zaburzeń przewodu pokarmowego, zaburzeń neurodegeneracyjnych i nocicepcji [8–12]. Dowody wskazują również, że CBD wywiera pozytywne efekty w naczyniach krwionośnych. Celem tej recenzji jest zbadanie tych dowodów i ustalenie, czy układ sercowo-naczyniowy jest potencjalnym celem terapeutycznym dla CBD. Ostatnia recenzja dotycząca bezpieczeństwa i skutków ubocznych CBD doszła do wniosku, że CBD wydaje się być dobrze tolerowany w wysokich dawkach i przy stosowaniu chronicznym u ludzi [13], co sugeruje jego potencjał bezpiecznego stosowania w klinice.
Ostre efekty naczyniowe związków kannabinoidowych zostały dobrze zbadane w różnych modelach. W różnych modelach in vivo i in vitro wykazano, że fitokannabinoidy i endokannabinoidy (kannabinoidy endogenne) powodują rozszerzenie naczyń. Jednakże potencjał, skuteczność i mechanizmy działania często się różnią. Na przykład wcześniejsze badania na naczyniach mózgowych królika wykazały, że THC i endokannabinoid anandamid (AEA) wywołujące rozszerzenie naczyń zależne było od aktywności cyklooksygenazy (COX) [14]. Później Randall i inni [15] wykazali, że AEA indukował rozszerzenie naczyń w perfundowanym łóżku krezkowym szczura, co zostało zahamowane przez antagonizm receptora CB1 i hamowanie hiperpolaryzacji potasu. Efekty rozszerzające naczynia AEA w tętnicach szczura są również zależne od rozmiaru naczynia; maksymalna odpowiedź na AEA jest większa w małych naczyniach oporu i obejmuje składnik zależny od śródbłonka, który nie występuje w większych tętnicach [16]. W aortach szczura odpowiedź rozszerzająca naczynia na AEA nie jest wrażliwa na antagonizm CB1 ani na desensytyzację TRPV1, ale jest wrażliwa na inhibicję białka Gi/o przy użyciu toksyny krztuśca (PTX) [17]. Dodatkowe różnice w efektach kannabinoidów można zaobserwować, porównując ten sam łóżko naczyniowe różnych gatunków. W aortach króliczych AEA wywołuje większe maksymalne rozszerzenie niż zaobserwowano w aortach szczura za pośrednictwem ścieżki wrażliwej na SR141716A (1 µm), która zależy od śródbłonka [18]. Wykazano również, że odpowiedzi na kannabinoidy zależą od związku kannabinoidowego użytego. Na przykład endokannabinoidy AEA i N-arachidonoyl-dopamina (NADA) wywołują podobne stopnie rozszerzenia naczyń w aortach szczura, ale przez różne mechanizmy [17]. Te badania podkreślają złożoność ostrych działań rozszerzających naczynia kannabinoidów na układzie krwionośnym (dla pełnej recenzji, zobacz [19]).
Oprócz bezpośrednich efektów naczyniowych kannabinoidów, wiele badań wskazuje, że endokannabinoidy są mediatorami zawału mięśnia sercowego i uszkodzenia niedokrwienia/reperfuzji, czynników ryzyka układu sercowo-naczyniowego oraz miażdżycy [20–22]. Potencjalne terapeutyczne zastosowania kannabinoidów innych niż CBD w chorobach sercowo-naczyniowych, takich jak ochrona serca, udar, zaburzenia rytmu serca i miażdżyca, zostały omówione gdzie indziej [22–24].
Dotychczasowe badania dotyczące wpływu kannabinoidów na układ krwionośny skupiały się głównie na reakcjach na endokannabinoidy, THC oraz syntetyczne ligandy, z tylko ograniczoną liczbą przeprowadzonych badań z użyciem CBD. Niemniej jednak efekty analogu CBD, jakim jest Abn-CBD, zostały zbadane. Jarai i inni [25] pokazali, że Abn-CBD powoduje hipotensję zarówno u myszy CB1+/+/CB2+/+, jak i u myszy CB1−/−/CB2−/−. Efekty Abn-CBD były hamowane przez wysokie stężenia SR141716A, denudację śródbłonka i CBD. W tym artykule pokazano, że CBD antagonizuje efekty rozszerzające naczynia Abn-CBD i AEA. Begg i inni [26] wykazali w komórkach śródbłonka ludzkiego pępkowego (HUVECs), że Abn-CBD powoduje hiperpolaryzację poprzez PTX-czułą aktywację dużych kanałów potasowych aktywowanych wapniem (BKCa). Podobnie, w izolowanych tętnicach krezkowych szczura Abn-CBD powoduje rozszerzenie naczyń zależne od śródbłonka, szlaku wrażliwego na SR141716A oraz hiperpolaryzacji potasowej poprzez kanały potasowe aktywowane wapniem o dużym, pośrednim i małym przewodnictwie (BKCa/IKCa/SKCa) [27]. Co ciekawe, wcześniejsze badania raportowały szlak niezależny od śródbłonka, który obejmował modyfikację kanałów Ca2+ przez Abn-CBD. Wyniki składające się z komponentów Abn-CBD-indukowanego rozszerzenia naczyń zależnego i niezależnego od śródbłonka są zgodne z podobnym badaniem tego samego roku, które wykazało, że w tętnicach krezkowych szczura rozszerzenie naczyń indukowane przez Abn-CBD było hamowane przez inkubację PTX oraz inkubację z innym analogiem CBD, O-1918, i rzeczywiście było zależne od śródbłonka [28]. Ostatnio pokazano również, że Abn-CBD powoduje rozszerzenie naczyń w tętnicy płucnej u ludzi poprzez podobne mechanizmy [29]. Te wyniki potwierdzają obecność związanej z śródbłonkiem receptora sprzężonego z białkiem Gi/o, który powoduje rozszerzenie naczyń poprzez hiperpolaryzację aktywowaną przez Abn-CBD.
Mniej badań skupiło się na badaniu wpływu CBD na naczynia krwionośne. Jarai i współpracownicy [25] nie stwierdzili wpływu perfuzji 10 µM CBD na tonus naczyniowy w zwężonym łóżku naczyniowym krezkowym szczura za pomocą fenylefryny. Niemniej jednak w segmencie tętniczym pobranym z łóżka naczyniowego krezkowego szczura, który został zamocowany na myografie Mulvany-Halpern i zwężony fenylefryną, CBD powoduje koncentracjopochodne, zależne od naczyń, niemal maksymalne rozszerzenie naczyń [28]. Niestety w tym badaniu nie zbadano mechanizmów leżących u podstaw tego efektu rozszerzającego naczynia CBD w tętnicach krezkowych szczura.
W tętnicach krezkowych u ludzi, bardzo niedawno pokazaliśmy, że CBD powoduje rozszerzenie naczyń segmentów tętniczych wcześniej zwężonych przez U46619 i endotelinę-1 (Stanley & O’Sullivan, 2012, w trakcie recenzji). W tętnicach krezkowych u ludzi, CBD-indukowane rozszerzenie naczyń ma pEC50 w zakresie środkowomikromolarnym, co jest podobne do tego obserwowanego w tętnicach krezkowych szczura. Jednakże CBD-indukowane rozszerzenie naczyń w tętnicach ludzkich osiąga maksymalną odpowiedź na poziomie około 40% redukcji przedimponowanego tonu. Udowodniliśmy również, że CBD-indukowane rozszerzenie naczyń w tętnicach krezkowych u ludzi jest zależne od śródbłonka, wiąże się z aktywacją receptora CB1 i aktywacją kanałów TRPV, uwolnieniem tlenku azotu oraz hiperpolaryzacją potasową (Rysunek 1) (Stanley & O’Sullivan, 2012, w trakcie recenzji).
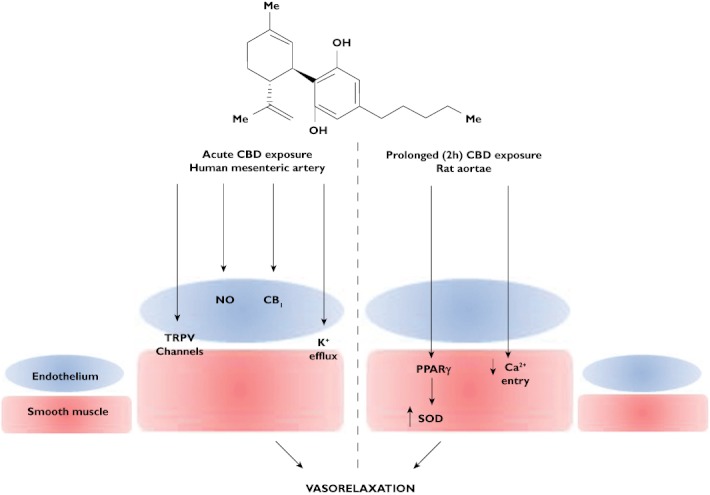
Figura 1.
Bezpośrednie efekty naczyniowe CBD mierzone w izolowanych tętnicach. TRPV, przemijający receptor potencjałowy waniloidowy; NO, tlenek azotu; CB1, receptor kannabinoidowy 1; PPARγ, gamma receptor aktywowany przez proliferator peroksysomów; SOD, dysmutaza ponadtlenkowa.
Warto zauważyć, że niedawno Ruiz-Valdepenas i inni [34] pokazali, że CBD hamuje lipopolisacharydowy (LPS)-indukowany rozszerzający naczynia efekt arteriol i żylaków. Sugerowano, że LPS może powodować hipotensję poprzez aktywację nowego, jeszcze nie zidentyfikowanego receptora kannabinoidowego, który mógłby być zahamowany przez SR141716A, ale nie przez AM251 [35]. Ponieważ CBD jest sugerowany jako antagonista tego receptora [25], może to wyjaśniać, dlaczego CBD hamuje LPS-indukowany rozszerzający naczynia efekt.
Agonisty receptora PPARγ wykazano, że mają pozytywne efekty na układ sercowo-naczyniowy, obejmujące zwiększoną dostępność tlenku azotu, obniżenie ciśnienia krwi oraz złagodzenie miażdżycy [36, 37]. Niektóre korzystne efekty ligandów PPARγ wynikają z działań przeciwzapalnych, takich jak hamowanie cytokin prozapalnych, zwiększanie cytokin przeciwzapalnych i hamowanie ekspresji indukowalnej syntazy tlenku azotu (iNOS) (dla przeglądu, zobacz [38]). Narastające dowody wskazują, że kannabinoidy są zdolne do wiązania się, aktywowania i wywoływania odpowiedzi mediowanej przez PPAR [39]. Wykazaliśmy, że główny aktywny składnik konopi, THC, aktywuje PPARγ, a THC powoduje czasowo zależne, śródbłonowo zależne, PPARγ-zależne rozszerzenie tętniczej aorty szczura [40, 41]. Następnie przetestowaliśmy, czy CBD może również aktywować PPARγ i czy to może pośredniczyć w niektórych efektach farmakologicznych kannabidiolu. W tych eksperymentach pokazaliśmy, że CBD jest słabym/częściowym agonistą receptora PPARγ, który zwiększa aktywność transkrypcyjną PPARγ w komórkach HEK293 z nadmiernym wyrażeniem PPARγ, a CBD wiąże się z domeną wiążącą ligand PPARγ z IC50≍ 5 µm[5]. Podobnie jak THC, CBD (w stężeniach powyżej 100 nM) wykazał również czasowo zależne rozszerzenie tętniczej aorty szczura. To czasowo zależne rozszerzenie zostało zahamowane przy użyciu antagonisty PPARγ GW9662 lub inhibitory dysmutazy ponadtlenkowej (SOD) dietylditiokarbaminianu (DETCA). Zwiększona aktywność SOD sprzyja rozszerzeniu naczyń poprzez redukcję reaktywnych form tlenu, a nasze dane są zgodne z innymi badaniami, które pokazują, że ligandy PPARγ powodują indukcję Cu/Zn-SOD [42]. Należy jednak zauważyć, że ostatnie prace sugerują, że stosowanie leków z grupy tiazolidynodonów (TZD) może prowadzić do obniżenia funkcji układu sercowo-naczyniowego i może prowokować incydenty takie jak ostre zawały mięśnia sercowego, niewydolność serca i udar [43–45]. Skutki uboczne związane z ligandami PPARγ obejmują przyrost masy ciała, obrzęk i zwiększenie poziomu lipidów w osoczu [46]. Jednakże słabi/częściowi agonisty receptora PPARγ mogą być pozbawieni tych szkodliwych skutków ubocznych [46]. CBD może okazać się mieć potencjał terapeutyczny jako agonista o niskim powinowactwie do PPARγ.
Hemodynamiczne efekty CBD.
Do tej pory przeprowadzono niewiele badań dotyczących reakcji hemodynamicznych na CBD. Jedno badanie wykazało, że u szczurów znieczulonych pentobarbitaliem CBD (w dawce 50 µg/kg i.v., ale nie 10 µg/kg) powoduje znaczący, ale przejściowy spadek ciśnienia krwi o 16 mmHg, nie wpływając jednocześnie na częstość akcji serca [47]. Jednakże inne badania nie donoszą o żadnych ostrej reakcji na leczenie CBD na częstość akcji serca ani ciśnienie krwi w badaniach na zwierzętach [48, 49]. W niedawnym przeglądzie, Bergamaschi i inni [13] doszli do wniosku, że leczenie CBD u ludzi nie prowadziło do zmian ciśnienia krwi ani częstości akcji serca. Stąd większość dowodów sugeruje brak wpływu CBD na hemodynamikę. Niemniej jednak, podobnie jak obserwowano to w przypadku innych związków kannabinoidowych, potencjalne hipotensyjne działania CBD mogą ujawnić się w modelach podwyższonego ciśnienia krwi. Dodatkowo, jakiekolwiek zmiany hemodynamiczne mogą być szybkie [47] i dlatego nie zaobserwowane w badaniach nad przewlekłym leczeniem.
CBD jest znane z działania przeciwlękowego. Leczenie CBD redukuje lęk związany z publicznym przemawianiem lub bodźcami wywołującymi strach u ludzi [10]. Wiele badań wykazało również, że CBD redukuje odpowiedź sercowo-naczyniową na sytuacje stresowe lub sytuacje związane z lękiem. Resstel i jego koledzy wykazali na szczurach Wistar, że pojedyncza dawka CBD (10 lub 20 mg/kg i.p.) zmniejszyła odpowiedź częstości akcji serca i ciśnienia krwi na warunkowe lęki [49] lub na ostre ograniczenie ruchu [48]. Efekt hamujący CBD na odpowiedź sercowo-naczyniową na stres wydaje się być zahamowany przez WAY100635, antagonistę receptora 5HT1A. Ten efekt zdaje się być pośredniczony w mózgu, ponieważ ten sam efekt CBD na odpowiedź sercowo-naczyniową mógł być imitowany, gdy CBD było podawane do łóżka jądra pasma końcowego (struktury limbicznej) [50]. Potencjalna zdolność leczenia CBD u ludzi do redukcji odpowiedzi sercowo-naczyniowej (a także behawioralnej) na stres może mieć istotne skutki dla rozwoju miażdżycy i nadciśnienia, które są znane z przyspieszenia przez stres [51, 52].
Kardioprotekcyjne efekty CBD.
Kilka badań wykazało, że CBD jest korzystny w zapobieganiu uszkodzeniom niedokrwiennym-powodowanym wątroby [53, 54] i mózgu [55]. W 2007 roku Durst i jego koledzy po raz pierwszy pokazali, że leczenie CBD in vivo (5 mg/kg i.p. przed niedotlenieniem, a następnie przez 7 dni po nim) znacząco zmniejszyło wielkość obszaru zawału serca, gdzie związano lewą przednią zstępującą (LAD) tętnicę wieńcową, co wiązało się z redukcją infiltracji leukocytów i stężenia cyrkulującego interleukiny (IL)-6. Ponadto pokazali, że ten efekt kardioprotekcyjny CBD nie mógł być odtworzony in vitro, sugerując, że efekty kardioprotekcyjne CBD wynikają z ogólnego efektu immunomodulacyjnego, a nie bezpośredniego wpływu na serce [56]. Walsh i inni [47] później pokazali, że pojedyncza dawka CBD (50 µg/kg i.v.) podana 10 minut przed niedokrwieniem lub 10 minut przed reperfuzją znacząco zmniejszyła wielkość obszaru zawału po związaniu tętnicy wieńcowej LAD. Wiązało się to również z redukcją komorowych skurczów przedwczesnych, sugerując dodatkową rolę przeciarytmiczną CBD. Rajesh i inni [57] wykazali, że 11-tygodniowe leczenie CBD in vivo (20 mg/kg i.p.) znacząco zmniejszyło dysfunkcję serca u myszy z cukrzycą, związane z zmniejszoną zapalnością mięśnia sercowego, stresem oksydacyjnym, stresem azotowym i bliznowaceniem, pośredniczącym w zmniejszonej aktywacji czynnika jąderkowego κB (NFκB), zmniejszonej aktywacji kinazy białkowej aktywowanej przez mitogen (MAPK) i zmniejszonej ekspresji cząsteczek adhezyjnych i czynnika martwicy nowotworów (TNF). Inne badania wykazały, że efekty przeciwzapalne CBD poprzez NFκB nie są pośredniczone przez aktywację receptorów CB1, CB2 ani Abn-CBD [58].
Wszystkie te dane sugerują, że leczenie CBD in vivo wykazuje istotne efekty kardioprotekcyjne, które mogą wynikać z bezpośredniego oddziaływania na serce lub za pośrednictwem ogólnego mechanizmu przeciwpowstępowego i przeciwutleniającego (patrz Tabela 1).
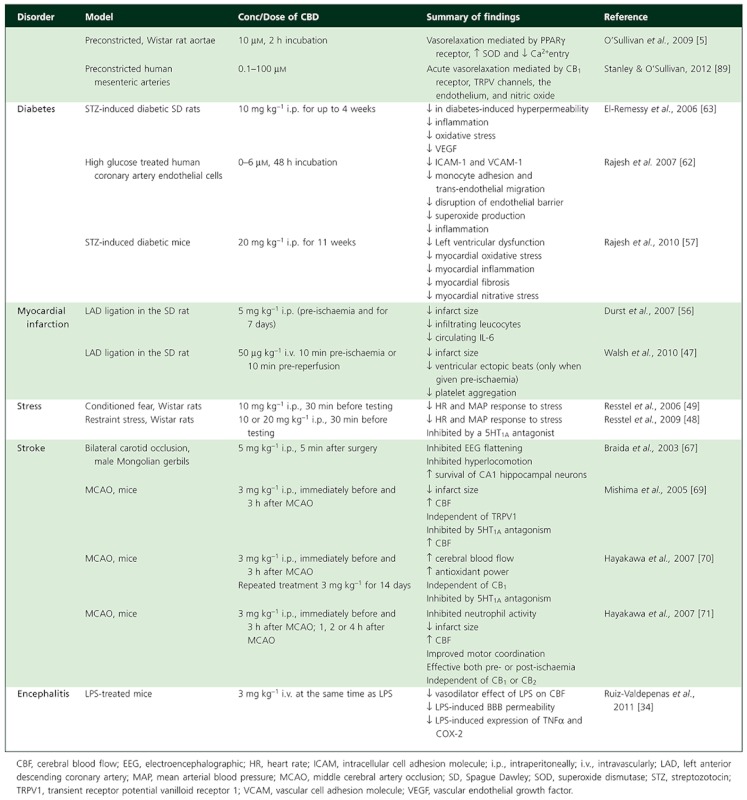
Tabela 1
Obecna baza dowodów popierająca terapeutyczną rolę CBD w zaburzeniach sercowo-naczyniowych.
Naczynioprotekcyjne efekty CBD.
Narasta zbiór dowodów wskazujących, że podawanie CBD może złagodzić negatywne skutki warunków związanych z dysfunkcją śródbłonka. Wysokie stężenia glukozy związane z cukrzycą zostały zgłoszone jako czynnik przyczyniający się do dysfunkcji śródbłonka. Wysoka glukoza sprzyja hamowaniu/rozłączaniu tlenku azotu śródbłonkowego, zwiększonej produkcji nadtlenku azotu, zwiększonym działaniom zwężających prostanoizoidów, zmniejszonym działaniom rozszerzających prostanoizoidów oraz zwiększonym reaktywnym formom tlenu [59]. Oprócz tych zmian, wysokie stężenia glukozy są również zgłaszane jako czynnik zwiększający adhezję leukocytów i migrację monocytów przez śródbłonek [60], co miało miejsce poprzez aktywność NFκB [61].
W komórkach śródbłonka ludzkich tętnic wieńcowych, długotrwałe wystawienie na wysokie stężenia glukozy spowodowało zwiększone poziomy cząsteczek adhezyjnych (ICAM-1 i VCAM-1), zakłócenie bariery śródbłonka, produkcję nadtlenku azotu mitochondrialnego, ekspresję iNOS oraz NFκB [62]. Wszystkie te efekty zostały zredukowane, gdy komórki były współinkubowane z CBD w porównaniu z samą wysoką glukozą. CBD również zmniejszyło adhezję monocytów i migrację tranśendotelialną, które są kluczowe w postępowaniu miażdżycy. Ani receptory CB1, ani CB2 nie były odpowiedzialne za pośredniczenie w efektach CBD [62]. Korzystając z modelu in vivo retinopatii cukrzycowej, El-Remessy i inni [63] podobnie stwierdzili, że leczenie CBD (10 mg/kg, co 2 dni, i.p.) zapobiegało nadmiernemu przepuszczaniu naczyń krwionośnych na barierze krew–siatkówka (BRB) i chroniło siatkówkę przed uszkodzeniem oksydacyjnym, stanem zapalnym oraz wzrostem cząsteczek adhezyjnych. Stąd ochrona naczyń krwionośnych przez CBD w modelu cukrzycy może prowadzić do zmniejszenia powikłań, takich jak retinopatia, choć może być to również wynikiem neuroprotekcyjnych efektów CBD.
Zakaźne zapalenie mózgu, modelowane poprzez parenteralne podanie LPS myszom, indukuje głęboką rozszerzalność arterioli, prowadzącą do nadmiernego ukrwienia mózgu i zakłócenia barierki krew-mózg (BBB) [34]. Podawanie CBD (3 mg/kg i.v.) jednocześnie z LPS utrzymało integralność BBB, zahamowało LPS-indukowaną rozszerzalność arterioli i żyłek, marginesację leukocytów oraz stłumiło nadmierne wydzielanie tlenku azotu. Choć bezpośrednio nie mierzono przepływu krwi w mózgu (CBF), wyniki obserwowane z różnych parametrów skłoniły autorów do sugerowania, że CBD złagodziło spadek CBF wywołany przez LPS [34].
Przeprowadziliśmy pewne wstępne badania dotyczące zdolności CBD do modulowania odpowiedzi naczyniorozszerzającej. Wykorzystując szczura Zucker, będącego modelem cukrzycy typu 2, w którym wiadomo, że jest upośledzona śródbłonkowa naczyniorozszerzalność, wykazaliśmy, że inkubacja aorty przez 2 godziny z CBD (10 µm) istotnie zwiększała odpowiedź naczyniorozszerzającą na acetylocholinę, endotelium-zależny naczyniorozszerzacz [64]. Podobnie wykazaliśmy, że inkubacja z CBD zwiększa odpowiedź naczyniorozszerzającą na acetylocholinę u spontanicznie nadciśnieniowego szczura (O’Sullivan, dane niepublikowane).
Podsumowując, te badania pokazują, że in vitro i in vivo, stosując hodowlę komórkową, izolowane tkanki i modele zwierzęce, CBD zostało wykazane, że zmniejsza negatywne skutki wysokich stężeń glukozy, cukrzycy i stanów zapalnych na naczynia krwionośne i na nadmierną przepuszczalność naczyń. Dotychczasowe badania nie jednoznacznie określają receptory, na które CBD oddziałuje w niektórych z tych badaniach, ale wspólnym motywem jest redukcja markerów zapalnych (patrz Tabela 1).
CBD w modelach udaru
Podawanie endogennych, syntetycznych lub fitokannabinoidów zostało wykazane jako środek neuroprotekcyjny w różnorodnych modelach chorób in vivo i in vitro, w tym w udarze [65]. Potencjał neuroprotekcyjny CBD w udarze niedokrwiennym został po raz pierwszy zbadany przez Hampson i współpracowników [66], gdzie szczury poddano zamknięciu tętnicy środkowej mózgu (MCAO), a CBD podane w chwili wystąpienia incydentu (5 mg kg−1, i.v.) oraz 12 godzin po zabiegu (20 mg kg−1, i.p.) zmniejszyło rozmiar obszaru niedokrwionego i upośledzenie neurologiczne o 50–60%. Podobnie, podanie CBD po udarze niedokrwiennym (1.25 do 20 mg kg−1, i.p.) chroniło przed utratą fal elektroencefalograficznych, hiperlokomocją i uszkodzeniem neuronalnym u myszy z MCAO [67]. Ostatnio wykazano, że CBD (3 mg kg−1, i.p.) redukuje objętość obszaru niedokrwionego po MCAO, niezależnie od receptora CB1 lub TRPV1, ale jest wrażliwe na antagonistę receptora 5HT1A WAY100135 (10 mg kg−1, i.p.) [68, 69]. Ponadto CBD (3 mg kg−1, i.p.) zapewniło neuroprotekcję nawet w przypadku podania do 2 godzin po reperfuzji, bez wytworzenia tolerancji [70, 71].
Przepływ krwi w mózgu jest zmniejszony lub całkowicie zablokowany w niektórych obszarach mózgu podczas udaru niedokrwiennego, dlatego przywrócenie odpowiedniego przepływu krwi jest kluczowe. CBD okazało się skuteczne w zwiększaniu przepływu krwi, mierzonego za pomocą laserowej dupleksy metody Dopplera, po MCAO i po reperfuzji (3 mg kg−1, i.p.) [69–71]. Zwiększony przepływ krwi indukowany przez CBD (3 mg kg−1, i.p.) był częściowo zmniejszony przez blokadę receptora 5HT1A, sugerując, że CBD może wywierać te korzystne efekty, przynajmniej częściowo, poprzez receptor serotoninowy 5HT1A [69]. Ekspozycja noworodków na hipoksję i niedotlenienie, przeprowadzona przez Alvareza i współpracowników [72], również wykazała zdolność CBD (0.1 mg kg−1, i.v., po urazie) do zapewnienia neuroprotekcji, obejmującej zachowanie krążenia mózgowego.
Jak wcześniej omawiano, podawanie CBD (3 mg kg−1, i.v.) jednocześnie z LPS utrzymuje integralność BBB [34]. Chociaż przepływ krwi mózgowej nie był bezpośrednio mierzony, wyniki obserwowane na podstawie różnych parametrów skłoniły autorów do sugestii, że CBD złagodziło spadek przepływu krwi mózgowej indukowany przez LPS [34]. Uszkodzenie BBB jest istotnym elementem w patofizjologii udaru niedokrwiennego [73]. Dlatego utrzymanie przez CBD tej bariery, jak wykazano w innych modelach chorób, może stanowić kolejny mechanizm ochrony CBD w udarze niedokrwiennym. Agonizm PPARγ może reprezentować kolejny mechanizm działania korzystnych efektów CBD w udarze. Wiele grup wykazało, że syntetyczne agonisty PPARγ, tiazolidynodiony (TZD), klasa leków stosowana w poprawie wrażliwości na insulinę, zmniejszają obszar niedokrwienia i poprawiają zdolność do funkcji po udarze u szczurów [74–78]. Poprawa ta jest związana z redukcją stanu zapalnego, który jest prawdopodobnym mechanizmem poprawy, a co najważniejsze, poprawa jest widoczna zarówno w przypadku podawania TZD przed, jak i po MCAO [75, 77]. Ostatnio pokazano, że leczenie CBD in vivo wykazuje efekty neuroprotekcyjne w modelu choroby Alzheimera, które były hamowane przez antagonistę PPARγ [6]. Podobnie pokazaliśmy w modelu kultury komórkowej BBB, że CBD przywraca zwiększoną przepuszczalność indukowaną przez niedotlenienie glukozy, co można było zahamować za pomocą antagonisty PPARγ (Hind & O’Sullivan, niepublikowane obserwacje).
Podsumowując, CBD zapewnia neuroprotekcję w modelach zwierzęcych i in vitro udaru. Oprócz bezpośrednich efektów neuroprotekcyjnych CBD, działanie to jest pośredniczone zdolnością CBD do zwiększenia przepływu krwi mózgowej i zmniejszenia nadmiernego przepuszczania naczyń krwionośnych w mózgu (patrz Tabela 1).
Haematologiczne efekty CBD
Dotychczasowe badania nad wpływem CBD na układ krwiotwórczy skoncentrowały się głównie na komórkach białych, migracji komórek białych i agregacji płytek krwi. CBD wykazuje wpływ na przeżycie i śmierć białych krwinek, migrację komórek białych oraz agregację płytek krwi.
Wpływ CBD na komórki białe krwi: CBD wpływa na przeżycie i śmierć komórek białych krwi, migrację tych komórek oraz agregację płytek krwi. Badania wykazują, że CBD wpływa na białe krwinki, regulując ich przeżycie i śmierć, migrację oraz zdolność do agregacji. Skutki te są zazwyczaj korzystne, prowadząc do zmniejszenia stanów zapalnych.
Wpływ CBD na migrację komórek białych: CBD ma wpływ na migrację komórek białych, co odgrywa istotną rolę w reakcjach zapalnych. Wpływ ten zazwyczaj zmniejsza zdolność komórek białych do przenikania do obszarów zapalnych, co może być korzystne w kontekście redukcji stanów zapalnych.
Wpływ CBD na agregację płytek krwi: CBD ma również wpływ na agregację płytek krwi, co może wpływać na proces krzepnięcia. Wpływ ten może być korzystny w kontekście redukcji ryzyka powstawania skrzepów.
Podsumowując, badania nad wpływem CBD na układ krwiotwórczy sugerują, że kannabidiol może mieć korzystny wpływ na komórki białe krwi, migrację komórek białych i agregację płytek krwi, co może przyczyniać się do zmniejszenia stanów zapalnych oraz ryzyka powstawania skrzepów. Jednak potrzebne są dalsze badania, aby lepiej zrozumieć mechanizmy działania i potwierdzić te efekty, zwłaszcza w kontekście wpływu CBD na ludzki organizm.
Wnioski
Podsumowując, niniejsza recenzja przedstawiła dowody na pozytywne efekty kannabidiolu (CBD) w układzie sercowo-naczyniowym, które zostały podsumowane w Tabeli 1. W izolowanych tętnicach bezpośrednie zastosowanie CBD powoduje zarówno ostry, jak i czasowy efekt rozszerzenia naczyń krwionośnych przedwężonych, a także wzmacnia rozszerzalność naczyń zależną od śródbłonka w modelach dysfunkcji śródbłonka. W warunkach in vivo leczenie CBD nie wydaje się mieć wpływu na spoczynkowe ciśnienie krwi ani na częstość akcji serca, ale zmniejsza reakcję układu sercowo-naczyniowego na różne rodzaje stresu. CBD odgrywa ochronną rolę w redukowaniu efektów niedokrwienia i reperfuzji serca, a także w zmniejszaniu dysfunkcji serca związanego z cukrzycą. Podobnie CBD pełni ochronną rolę w redukowaniu szkód niedokrwiennych w modelach udaru mózgu, częściowo poprzez utrzymanie przepływu krwi w mózgu. W modelach zmienionej przepuszczalności naczyń, CBD zmniejsza nadmierną przepuszczalność barier w cukrzycy i po podaniu LPS zmniejsza przepuszczalność barier w mózgu. Podsumowując, te dane sugerują, że układ sercowo-naczyniowy stanowi rzeczywisty cel terapeutyczny dla CBD. Niemniej jednak miejsca działania CBD w większości tych reakcji pozostają do ustalenia. Czy te odpowiedzi na CBD przekładają się również na ludzki układ sercowo-naczyniowy, również pozostaje do ustalenia.
źródło: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3579247/
