Układ endokannabinoidowy (ECS) reguluje homeostazę komórkową i metabolizm całego organizmu. Istnieje autonomiczny ECS w trzustce endokrynnej, obejmujący receptor kannabinoidowy 1 (CB1R), który występuje w komórkach β. W tym kontekście omawiamy konflikty związane z funkcją(-ami) endokannabinoidów w trzustce endokrynnej, które wywołały zamieszanie przy definiowaniu roli ECS w wyspach trzustkowych, zwłaszcza roli(-i) CB1R w komórkach β. Omawiamy również najnowsze opublikowane dane dotyczące ECS w wyspach trzustkowych. CB1R w szczególności nie jest wyłącznie negatywnym modulatorem wydzielania insuliny, ponieważ uczestniczy także w intra-wyspowym zapaleniu podczas spożycia dużej ilości tłuszczu i cukru oraz działa jako negatywny regulator przeżywalności i wymiany komórkowej β. Rozważamy również możliwość wykorzystania CB1R jako celu terapeutycznego w leczeniu cukrzycy.
Układ endokannabinoidowy (ECS) to starożytna sieć sygnałowa zaangażowana w utrzymanie homeostazy komórkowej (15). Składa się z dwóch endokannabinoidów (EC), anandamidu (AEA) i 2-arachidonoyloglicerolu (2-AG); ich receptorów sprzężonych z białkiem G, kannabinoidowych 1 (CB1R) i 2 (CB2R); niestandardowego GPR55; oraz enzymów odpowiedzialnych za syntezę i degradację EC (34, 35) (Ryc. 1). EC są syntetyzowane na żądanie przez enzymy N-acylofosfatyloetanolaminy-fosfolipaza D (NAPE-PLD; syntaza AEA) i diacyloglicerol lipaza (DAGL; syntaza 2-AG) z związków prekursorowych na bazie arachidonianu związanych z błoną komórkową (34). Po wydzieleniu i internalizacji, EC są szybko degradowane przez hydrolazę amidową kwasów tłuszczowych (FAAH) i monoacyloglicerolową lipazę (MAGL), a produkty rozkładu są ponownie przetwarzane (34) (Ryc. 1A). W otyłości, jak to ma miejsce w przypadku spożywania diety zachodniej bogatej w tłuszcze i cukry, ECS staje się nadaktywny, głównie poprzez zwiększenie syntezy EC (8, 39).
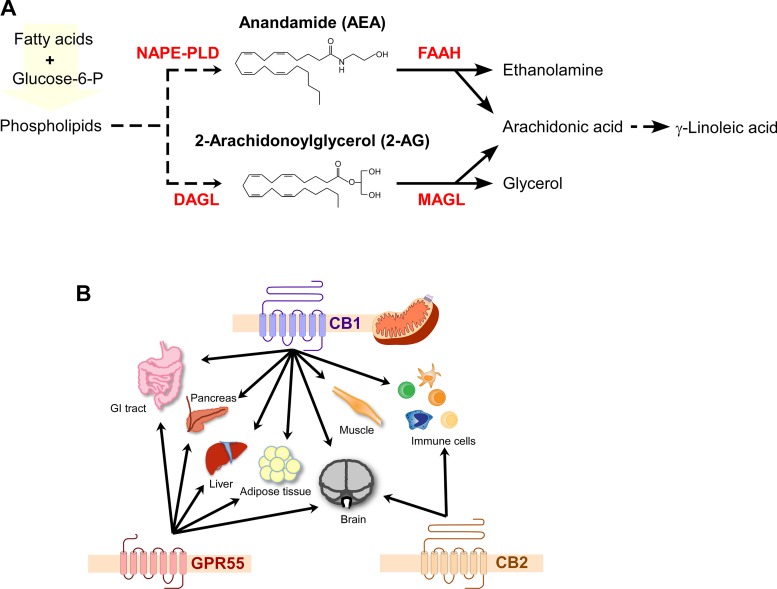
Rysunek 1. Układ endokannabinoidowy (ECS). A: schemat syntezy i degradacji endokannabinoidów (EC). B: receptory kannabinoidowe (CBR) obejmują klasyczne receptory kannabinoidowe 1 i 2 (CB1R i CB2R) oraz niestandardowy receptor sprzężony z białkiem G 55 (GPR55), które są obecne na błonie komórkowej. Dodatkowo, CB1R jest również obecny w zewnętrznej błonie mitochondrialnej w niektórych tkankach. Wszystkie trzy receptory CBR są ekspresowane w mózgu. Na obwodzie CB1R i GPR55 są ekspresowane w tkankach, jak pokazano.
Receptory kannabinoidowe (CBR) są obecne na błonie komórkowej wielu narządów (rysunek 1B), regulując szereg funkcji. Podczas gdy CB2R występuje głównie w komórkach układu immunologicznego (4, 18), CB1R jest obfity w mózgu, gdzie kontroluje presynaptyczną hamulację zwrotną pobudzenia oraz reguluje apetyt i reakcję nagrody w podwzgórzu. Na obwodzie reguluje motorykę jelit (52) i wydzielanie incretin [glukozozależnego peptydu insulinotropowego (GIP) i peptydu podobnego do glukagonu (GLP-1)] w jelitach. CB1R jest wyrażany w innych tkankach o funkcji endokrynnej, takich jak nadnercza, jajniki, jądra i nasieniowody (10). W trzustce endokrynnej aktywacja CB1R przez autonomiczną syntezę EC i autokrynne działanie w β-komórkach pełni funkcję sprzężenia zwrotnego negatywnego dla wielu funkcji β-komórkowych (19, 26).
CBR są sprzężone z białkiem Gαi/o i hamują aktywację adenylanu cyklazy (AC) oraz aktywność cAMP-PKA. Aktywują również MAPK i hamują kanały wapniowe typu L, N i P/Q oraz kanały potasowe o prostokątnej charakterystyce wewnętrznej, prowadząc do hamowania przekazu sygnału i zmniejszonego uwalniania produktów wydzielniczych z β-komórek (19, 20). W wątrobie i β-komórkach aktywacja CB1R ujemnie wpływa na szlak receptora insuliny (IR) poprzez bezpośrednią interakcję jej podjednostki Gαi z podjednostką β IR (27), a osłabiona aktywacja CB1R poprawia działanie insuliny (12, 33). Przeanalizujemy literaturę w kontekście modulacji funkcji wysp trzustkowych.
Konflikty — Brzydkie.
Konflikt 1. Które komórki wysp trzustkowych zawierają receptory kannabinoidowe (CBR), a które syntetyzują endokannabinoidy (EC)? Brak specyficzności przeciwciał doprowadził do sprzecznych doniesień dotyczących obecności CBR w różnych komórkach wysp trzustkowych. Dowody wskazują, że ECS nie jest wyrażony ani w tkance zrazikowej, ani przewodowej dojrzałej trzustki. W trzustce endokrynnej CB1R był różnie zgłaszany w komórkach α-, δ- i β-komórkach (7, 24, 26, 43, 56). Ostatnio wykazaliśmy, analizując molekularnie pojedyncze komórki rozproszone z ludzkich wysp, że CB1R jest wyrażany we wszystkich β-komórkach, ale nie w komórkach α- lub δ- (19). My i inni również zgłosiliśmy, że izolowane wyspy zawierają autonomiczny ECS (7, 26): EC są syntetyzowane na żądanie w odpowiedzi na glukozę w sposób zależny od stężenia, przy czym 2-AG jest najbardziej obfitującym EC (7, 26, 39). W trakcie rozwoju EC wpływają na ostateczną architekturę dorosłych wysp (38), co wskazuje na rolę rozwojową ECS w wyspach.
Konflikt 2. Czy istnieją różnice między ekspresją CBR w wyspach u gryzoni a ludzi, które dodają niepewności? Ludzki gen CB1R koduje trzy różne izoformy białek o zróżnicowanej powinowactwie do ligandu i tkankowym rozmieszczeniu (19, 49, 53, 55). Ludzkie β-komórki i hepatocyty obficie wyrażają CB1b, krótszą izoformę praktycznie nieobecną w mózgu (19). Istnienie izoform, które mogą być preferencyjnie ukierunkowane, wprowadza nową zmienną do równań terapeutycznych. Podejścia farmakologiczne do ukierunkowywania aktywności CB1R w obwodzie były problematyczne ze względu na lipofilową naturę modyfikatorów CBR, które swobodnie przenikają barierę krew-mózg.
Konflikt 3. Jaki jest dowód na obecność innych CBR oprócz CB1R w wyspach? Całe wyspy zawierają makrofagi, naczynia krwionośne i zakończenia nerwowe oraz wykazują transkrypty dla CB2R, ale w znacznie mniejszym stopniu (różnica 100-krotna) niż CB1R (7, 16, 24). Syntetyczny antagonist CB2R AM630, w ilościach farmakologicznych, zmniejszał EC-indukowaną redukcję oscylacji stężenia Ca2+ wewnątrz wysp w sposób zależny od toksyny pertusisowej (24). Syntetyczny agonista CB2R JWH133 zmniejszał wydzielanie insuliny z izolowanych mysich i ludzkich wysp (7, 24), podczas gdy inny syntetyczny agonista CB2R JWH015, zwiększał wydzielanie insuliny stymulowane glukozą z izolowanych mysich wysp (57). U myszy JWH133 zmniejszał poziomy glukozy we krwi po obciążeniu glukozą, podczas gdy AM630 wywoływał przeciwny efekt (6). W związku z tym istnieje konflikt, zwłaszcza między wynikami in vivo a in vitro przy użyciu środków modyfikujących CB2R. GPR55 jest silnie wyrażany w mózgu (50) i sygnalizuje poprzez białka Gα13 i Gq (29). Odkryto wiele związków endogennych i syntetycznych, w tym kannabinoidy, takie jak THC i AEA w stężeniach nanomolowych (2, 48), które związują się z nim. Jego endogenne ligandy wydają się być lizofosfatydyloinozytolem i jego pochodną 2-arachidonoyloinozytolem. Na obwodzie wykazano, że jest wyrażany w białej tkance tłuszczowej, wątrobie, przewodzie pokarmowym i wyspach (21, 46) (rysunek 1B). Aktywacja GPR55 przez O-1606, syntetyczny agonista, zwiększała mobilizację stężenia Ca2+ stymulowaną glukozą w β-komórkach i wydzielanie insuliny, a na podstawie immunohistochemii, GPR55 kolokalizuje się z barwieniem insulinowym (46). Inne agonisty GPR55, takie jak Abn-CBD, miały zdolność zwiększenia wydzielania insuliny z linii komórkowej insulinoma (40). In vivo, u gryzoni, aktywacja GPR55 prowadzi do poprawy tolerancji glukozy i zwiększenia poziomów glukozy stymulowanej glukozą insuliny (40, 46). GPR55 bierze udział nie tylko w funkcji β-komórkowej, ale, podobnie jak CB1R, również utrzymaniu masy β-komórkowej. Blokada GPR55 zmniejszała proliferację i przeżycie komórek oraz powodowała przesunięcie metaboliczne ku fosforylacji oksydacyjnej, zmniejszając produkcję mleczanu i karnityny oraz sygnalizację PI3K-Akt (9). U myszy z cukrzycą wywołaną streptozotocyną, leczenie Abn-CBD zwiększało liczbę β-komórek w wyspach, obniżało poziomy glukozy we krwi i zwiększało poziomy insuliny; te efekty były zależne od obecności GLP-1R i GIPR, ponieważ myszy z ogólnoustrojowym wyłączeniem tych receptorów nie wykazywały zmian w poziomach glukozy ani insuliny po leczeniu Abn-CBD w porównaniu z pojazdem (41). Jakikolwiek wpływ fizjologicznych poziomów endogennych ligandów na aktywność GPR55 w β-komórkach nie został przedstawiony. Należy zauważyć, że opisano heterodimery rodziny receptorów kannabinoidowych, które wpływają na ich sygnalizację wewnątrzkomórkową (3, 11, 25). Istnienie tych interakcji, chociaż jeszcze nie opisanych w β-komórkach, może komplikować badania poszczególnych receptorów: przyszłe badania takich możliwych interakcji są uzasadnione.
Konflikt 4. Czy endokannabinoidy są promiskuityczne, czy istnieje jeden ligand dla jednego receptora? AEA ma wyższe powinowactwo do receptora CB1 niż do receptora CB2, podczas gdy 2-AG łączy się z obiema receptorami w jednakowym stopniu. Jednak endokannabinoidy zdają się także aktywować inne receptory, w tym GPR55, w zakresie nanomolowym (45). Przyjmując, że wszystkie trzy receptory są obecne w komórkach wysp trzustkowych, stosowanie egzogennych endokannabinoidów do badania specyficznej roli CB1R może nie być najlepszym podejściem. Istnieją bardziej konkretne alternatywy przy użyciu syntetycznych ligandów, takich jak ACEA, choć istnieją pewne, takie jak AM251, SR141716A lub nowa substancja LH-21, które są znanymi antagonisami CB1R, a jednocześnie wykazują aktywność agonistyczną wobec GPR55 (14, 42, 45, 47). Ponadto istnieją różnice w powinowactwie między gatunkami (55), które należy wziąć pod uwagę przy badaniu ich wpływu na wyspy trzustkowe u ludzi w porównaniu z gryzoniami. Ostatnie dane pokazują, że inne receptory, takie jak receptor potencjału TRPV1, aktywowane przez kannabinoidy (58), są zaangażowane w regulację poziomu Ca2+ w komórkach, co wpływa na funkcję wysp trzustkowych (1, 36). Co ważne, komórki β- i α-trzustki wykazują ekspresję kluczowych enzymów do metabolizmu AEA (37, 54), a stosowanie kultur komórkowych mieszanych populacji lub stosowanie całości wysp nie może dostarczyć pełnego obrazu roli receptora CB1 w komórkach β, ani, rzeczywiście, roli dowolnego indywidualnego receptora. Ponadto znaczne ilości krążącej AEA znajdują się we krwi (39), co może wprowadzić zamieszanie w wynikach dotyczących endogennych endokannabinoidów w wyspach trzustkowych. Endokannabinoidy nie tylko sygnalizują poprzez różne receptory, ale również poprzez różne podjednostki receptorów kanabinoidowych. Oprócz sygnalizowania poprzez podjednostkę Gαi, kilka ligandów, w zakresie mikromolowym, sygnalizuje poprzez podjednostkę Gq receptora CB1 w neuronach hipokampu, która łączy się z fosfolipazą C w celu uwolnienia Ca2+ z wnętrza komórki i powodzenia depolaryzacji (28). W rzeczywistości w komórkach wysp trzustkowych mikromolarne stężenia syntetycznych i endogennych agonistów receptora CB1 indukują wydzielanie insuliny (30–32), co wskazuje, że suprafizjologiczne stężenia kannabinoidów mogą także sygnalizować poprzez podjednostkę Gq w komórkach β.
Dysfunkcja komórek β — złe
Wczesne badania skłoniły nas do wniosku, że aktywowane receptory CB1 są jedynie negatywnymi regulatorami AC, zmniejszającymi bodźce do wydzielania insuliny, takie jak inkretyny i pobudzający adenyloniany cyklazę peptyd przysadkowy, które zależą od aktywacji AC (Fig. 2). Jednakże pojawia się bardziej złożony obraz, implicujący wpływ na kanały jonowe K+ i Ca2+, sygnalizację MAPK, syntezę ceramidów, funkcję mitochondriów oraz sygnalizację Akta (20, 27). Ponadto CB1R w komórkach β wpływa na żywotność komórkową. Poprzez bezpośrednią interakcję aktywowanego receptora CB1 z receptorami insuliny, fosforylacja Akta i Bad są zmniejszone (27), prowadząc do zmniejszonej proliferacji i zwiększonej śmierci komórkowej β. W przeciwieństwie do tego, usunięcie CB1R w komórkach β zapobiegało indukowanej dietą produkcji oksydacyjnego stresu wewnątrz wysp trzustkowych i redukowało aktywację szlaku MAPK, co zmniejszało aktywację Nlrp3 inflamasomu i rozpad kaspazy 3 indukowane wysokim stężeniem glukozy i palmitynianu, co prowadziło do zachowania żywotności wyspy (20) (Fig. 2). Ponadto CB1R jest zaangażowany w pośredni sposób w żywotność wysp: CB1R na miejscowych makrofagach wysp i trzustki, gdy jest aktywowany, aktywuje inflamasom Nlrp3 i zwiększa wydzielanie IL-1β z makrofagów; w ten sposób uczestniczy w indukowanej dietą zapalnej odpowiedzi wyspy i dysfunkcji komórkowej β (22, 23). W zachodnich dietach występuje stała stymulacja komórek β z powodu utrzymującej się dysglykemii. Nieustanne bodźce prowadzą nie tylko do zwiększenia wydzielania insuliny, ale także do wzrostu lokalnych poziomów endokannabinoidów. Ponadto podwyższone poziomy endokannabinoidów, poprzez stymulowanie receptora CB1 w makrofagach i komórkach β, aktywują odpowiedź zapalną, powodując dysfunkcję komórkową β i apoptozę.
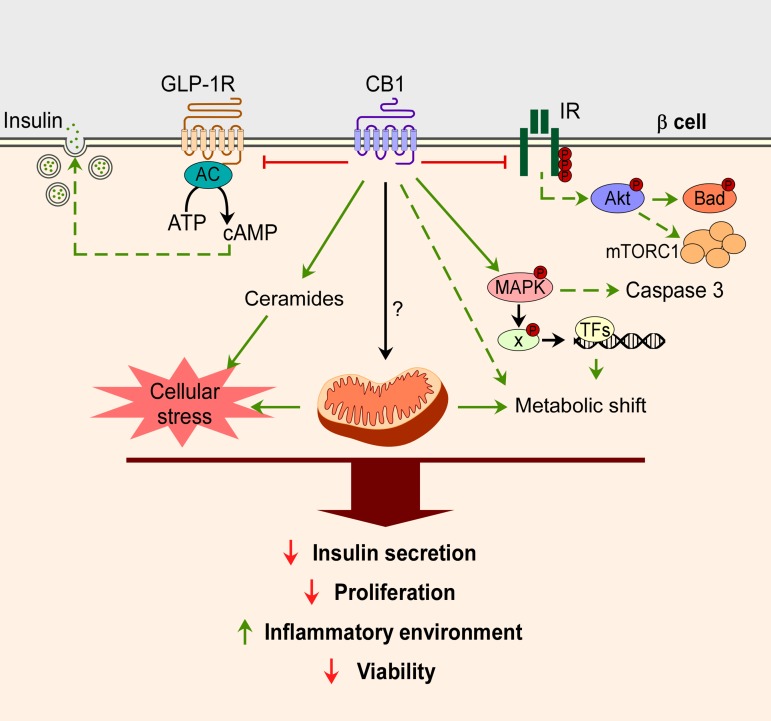
Rysunek 2.
Działania receptora kanabinoidowego 1 (CB1R) w komórkach β. Aktywacja CB1R powoduje obniżenie aktywacji receptora peptydu przysadkowego przypominającego glukagon (GLP)-1 i receptora insuliny (IR), co z kolei zmniejsza GLP-1-śródwydzielane wydzielanie insuliny, a także redukuje fosforylację Aktu i jego szlaki sygnalizacyjne. Aktywacja CB1R aktywuje szlak MAPK i indukuje rozpad kaspazy 3 oraz ekspresję czynników transkrypcyjnych, które prowadzą do przesunięcia metabolizmu w komórkach β. Bezpośrednie lub pośrednie działanie CB1R na mitochondria w komórkach β pozostaje do ustalenia, ale wraz z indukowaniem syntezy ceramidów przez CB1R, przesunięcie metabolizmu prowadzi do zwiększonego wewnątrzkomórkowego stresu oksydacyjnego. Ogółem, chroniczne nadaktywowanie układu endokannabinoidowego (ECS) w komórkach β prowadzi do ograniczonej funkcji, tj. zmniejszonego wydzielania insuliny, zmniejszonej proliferacji, aktywowanych makrofagów miejscowych i zmniejszonej żywotności komórek β.
Dobre
Omówiliśmy, że komórki β zawierają autonomiczny układ endokannabinoidowy (ECS), a endokannabinoidy (ECs) są wytwarzane na żądanie w odpowiedzi na stymulację glukozy i działają autokrynnie. Ten rodzaj sygnalizacji działa jako ujemna informacja zwrotna, aby uniknąć hipoglikemii i utrzymać homeostazę w wydzielaniu insuliny. Ponadto wydaje się, że ECS w komórkach β ewoluował, aby chronić przed stanem zapalnym, który potencjalnie byłby szkodliwy dla komórek β. CB1R w komórkach β pełni funkcję broni dwuobrotowej: 1) gdy jest aktywowany ostrożnie, chroni przed nadmierną aktywnością komórek β, 2) ale w stanie otyłości, ECs w krążeniu i w wyspach trzustkowych są chronicznie zwiększone, a ich aktywacja CB1R — nawet gdy komórki β nie są w stanie poposiłkowym — w końcu utrudnia funkcję komórek β, prowadząc do zapalenia wysp trzustkowych i zwiększonej apoptozy komórek β. Antagonizm CB1R redukuje zapalenie wysp trzustkowych indukowane dietą (22, 23, 47), zwiększa fosforylację Aktu i Bad, oraz zwiększa sygnalizację mTORC1 (5, 27), tym samym sprzyjając odnowie komórek β i ich przeżywalności oraz zapobiegając apoptozie, co może być wykorzystane jako terapia w leczeniu cukrzycy. Jednak aktywacja receptorów kannabinoidowych (CBRs) jest skuteczną terapią w niektórych rodzajach nowotworów, w zależności od ekspresji receptora, ponieważ aktywacja CB1R może zmniejszać proliferację komórkową i indukować apoptozę (44). Indywidualne i tkankowe terapie będą musiały zostać wzięte pod uwagę przy rozważaniu ECS jako celu terapeutycznego.
Wnioski.
ECS to potencjalny cel dla nowych terapii chroniących wyspy trzustkowe przed zapaleniem i apoptozą. Wczesne lata 2000 roku przyniosły dostępność rimonabantu do leczenia otyłości (13, 17, 51), i mimo osiągnięcia obiecujących wyników metabolicznych, pojawiły się niekorzystne efekty psychiatryczne. Być może efekty te można pokonać dzięki drugiej generacji syntetycznych modyfikatorów CB1R, które nie przenikają przez barierę krew-mózg. Ponadto izoformy CB1R mogą być nowymi celami dla projektowania leków, w tym oligonukleotydy morfolino do celowania w konkretne warianty skrawków. Rozważać można również zmiany w rodzajach tłuszczów w diecie, aby zmniejszyć syntezę EC z prekursorów.
źródło: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6139496/
