Trzustka składa się z dwóch odrębnych komponentów: zewnątrzwydzielniczej trzustki, zbiornika enzymów trawiennych, oraz komórek endokrynnych, źródła ważnego hormonu metabolicznego – insuliny. Komórki β trzustki posiadają ograniczoną zdolność regeneracji, a utrata tych komórek w chorobach takich jak cukrzyca typu 1 wymaga interwencji terapeutycznej. Wiodącą strategią przywracania masy komórek β jest generowanie i przeszczepianie nowych komórek β pochodzących od ludzkich pluripotencjalnych komórek macierzystych. Inne podejścia obejmują stymulowanie proliferacji endogennych komórek β, przeprogramowywanie komórek nie-β na komórki przypominające komórki β oraz pozyskiwanie wysp Langerhansa z genetycznie zmodyfikowanych zwierząt. Razem te podejścia stanowią bogate źródło rozwoju terapeutycznego w dziedzinie regeneracji trzustki.
Trzustka pełni kluczową rolę w kontroli spożycia energii i metabolizmu, składając się z dwóch morfologicznie i funkcjonalnie odrębnych komponentów: zewnątrzwydzielniczej trzustki (komórek zrazikowych i komórek przewodów trzustkowych) oraz wewnątrzwydzielniczej trzustki (wyspy Langerhansa). Komórki zrazikowe wytwarzają szereg enzymów trawiennych, takich jak lipazy, proteinazy i amylazy, które są wydzielane do przewodów trzustkowych i płyną do jelita cienkiego, aby trawić tłuszcze, białka i węglowodany w celu ich absorpcji. Wewnątrzwydzielnicze wyspy stanowią mniej niż 5% całkowitej masy trzustki, ale mimo to ich liczba przekracza miliard komórek u ludzi. Każdy z pięciu głównych rodzajów komórek wysp syntetyzuje i wydziela główny hormon: insulinę (komórki β), glukagon (komórki α), somatostatynę (komórki δ), polipeptyd trzustkowy (komórki PP) i grelinę (komórki ε). Insulina i glukagon są uwalniane bezpośrednio do krążenia krwi poprzez gęstą wewnątrzwyspową sieć naczyniową i odgrywają istotną rolę w regulacji poziomu glukozy we krwi.
Odrębne choroby dotykają zewnątrzwydzielniczej i wewnątrzwydzielniczej trzustki. Zapalenie trzustki i nowotwory trzustki, z których większość to rak przewodowy, wywodzą się z zewnątrzwydzielniczej trzustki, podczas gdy cukrzyca i rzadkie guzy neuroendokrynne trzustki pochodzą z wewnątrzwydzielniczej trzustki. Szacuje się, że cukrzyca dotyka ponad 300 milionów ludzi na świecie i stanowi poważny i rosnący problem zdrowotny we współczesnym świecie. Powikłania wynikające z długotrwałej cukrzycy obejmują niewydolność nerek, chorobę naczyń obwodowych, udar mózgu i chorobę wieńcową; te powikłania generują ogromne obciążenia medyczne i społeczne, a także powodują przedwczesne zgony. Większość pacjentów z cukrzycą cierpi na cukrzycę typu 2 (T2D), chorobę przypisywaną oporności na insulinę przez narządy obwodowe, takie jak wątroba, tłuszcz i mięśnie. Ostatnie badania genetyczne i analizy histologiczne wykazały, że pacjenci z T2D mają znacznie mniej komórek β niż osoby zdrowe1–4. Cukrzyca typu 1 (T1D), która stanowi około 5-10% wszystkich przypadków cukrzycy, jest chorobą autoimmunologiczną, w której komórki β są selektywnie niszczone, prowadząc do ciężkiego niedoboru insuliny, który musi być leczony codziennymi zastrzykami insuliny dla przeżycia. Razem te choroby stanowią dużą i rosnącą populację pacjentów z niedoborem komórek β trzustki.
Istnieje długa historia badań nad regeneracją trzustki, sięgająca niemal stu lat5. Epidemia cukrzycy w ostatnich dziesięcioleciach zainspirowała liczne badania nad rozwojem, homeostazą i regeneracją trzustki. Badania na zwierzętach sugerują, że zewnątrzwydzielnicza trzustka posiada wrodzoną zdolność do regeneracji i może szybko i całkowicie wrócić do zdrowia po chorobach zewnątrzwydzielniczych, takich jak ostre zapalenie trzustki. W przeciwnym razie wewnątrzwydzielnicze wyspy mają ograniczoną zdolność regeneracji u dorosłych. Faktycznie pozostaje niejasne, czy dorosła ludzka trzustka może spontanicznie regenerować komórki β w sposób fizjologicznie znaczący. Znaczna utrata komórek β prowadzi więc do trwałego niedoboru wewnątrzwydzielniczego i nieodwracalnej cukrzycy. Istnieje coraz większe porozumienie, że podejście medycyny regeneracyjnej będzie pomocne, a nawet konieczne, w leczeniu pewnych postaci cukrzycy, w tym T1D, a być może także podtypu T2D, w którym występuje znaczna utrata komórek β. Nauczenie się, jak zwiększyć lub indukować wrodzoną zdolność regeneracyjną wysp endokrynnych i opracowywanie nowych strategii wytwarzania komórek β wydzielających insulinę będzie miało głębokie implikacje dla rozwoju terapeutycznego leczenia cukrzycy. W tym artykule podsumowujemy naszą obecną wiedzę na temat regeneracji zewnątrzwydzielniczej i wewnątrzwydzielniczej trzustki oraz omawiamy różne strategie terapeutycznej regeneracji i naprawy.
Większość badań nad regeneracją trzustki skupia się na wewnątrzwydzielniczych wyspach, ze względu na ich kluczowe znaczenie w cukrzycy. Historycznie badania regeneracji wysp opierały się na modelach uszkodzenia u gryzoni, takich jak pankreatektomia, podwiązanie przewodów trzustkowych i chemiczne usunięcie komórek wysp. W pankreatektomii usunięcie do 90% trzustki szczura nie wpływa na homeostazę glukozy, co sugeruje dużą rezerwę, ponieważ 10% masy wysp wystarcza do utrzymania kontroli stężenia glukozy we krwi6–8. W przeciwieństwie do tego, resekcja 50–60% trzustki u ludzi wywołuje cukrzycę zależną od insuliny9,10. Młode gryzonie wykazują wzrost tkanki i odrost z przekroju po pankreatektomii6,7. Obserwacje rzadkich próbek od dzieci sugerują również wzrost tkanki po pankreatektomii11. Jednak zdolność do tego rodzaju regeneracji gwałtownie maleje u zwierząt dorosłych i jest nieobecna u ludzi dorosłych8,10,12.
Drugi model uszkodzenia stosowany do badania regeneracji trzustki to podwiązanie przewodów, które imituje przewlekłe zapalenie trzustki. Fizyczne podwiązanie przewodów trzustkowych powoduje masową śmierć komórek zrazikowych, ale wyspy endokrynne są oszczędzone i nie obserwuje się istotnej regeneracji endokrynnej13,14. W trzecim modelu uszkodzenia komórek β trzustki można specyficznie zniszczyć za pomocą streptozotocyny (STZ) lub alloxanu, toksyn chemicznych strukturalnie przypominających glukozę i selektywnie importowanych do komórek β. W zależności od dawki leku, cała masa komórek β może zostać częściowo lub prawie całkowicie zniszczona w kilka dni. Obszerne badania nie dostarczyły przekonujących dowodów na regenerację komórek β u zwierząt dorosłych po chemicznym uszkodzeniu12,15.
Mimo braku istotnej regeneracji wysp w modelach uszkodzenia, obserwuje się hiperplazję wysp w czasie ciąży, w otyłości lub w warunkach oporności na insulinę u zwierząt16–19. Na przykład masa komórek β trzustki myszy zwiększa się 3–5-krotnie w trakcie ciąży, pobudzana przynajmniej częściowo przez hormony ciążowe, laktogen placentalny i prolaktynę, oraz zaangażowanie sygnalizacji przez serotoninę, Menin i FoxM120–23. Otyłość wywołana dietą bogatą w tłuszcze u myszy jest również towarzyszona imponującym wzrostem masy komórek wysp24. Doświadczalna oporność na insulinę, taka jak wyłączenie receptorów insulinowych w wątrobie, powoduje nawet dziesięciokrotny wzrost masy komórek β25. Szlaki molekularne, które prowadzą do tych wzrostów masy komórkowej w otyłości i oporności na insulinę, nie zostały jeszcze w pełni wyjaśnione.
Samodzielna replikacja utrzymuje masę komórek β. Tempo proliferacji komórek β jest dość wysokie u młodych gryzoni, ale szybko maleje wraz z wiekiem26,27. Na przykład jedno badanie szacuje tempo proliferacji na około 4% dziennie u jednomiesięcznych szczurów i 0,5% dziennie u szczurów siedmiomiesięcznych28. Ponadto znaczna hiperplazja wysp może być wywołana u dorosłych zwierząt w trakcie ciąży lub otyłości. Skąd pochodzą te dodatkowe komórki wysp? W przełomowym badaniu analizy linii genetycznej u myszy z użyciem kierowców specyficznych dla komórek β wykazano, że głównym mechanizmem uzupełniania komórek β w homeostazie lub po uszkodzeniu jest replikacja istniejących już komórek β29 (Fig. 1). Rola replikacji jest znacznie mniej klarowna u ludzi, ponieważ bardzo mało replikujących się komórek β ludzkich (ocenianych na podstawie barwienia histologicznego proliferacyjnymi antygenami, takimi jak Ki-67 i PCNA) można znaleźć w próbkach trzustki pobranych podczas autopsji u zdrowych, uszkodzonych, ciężarnych czy otyłych dorosłych ludzi3,10,30,31.
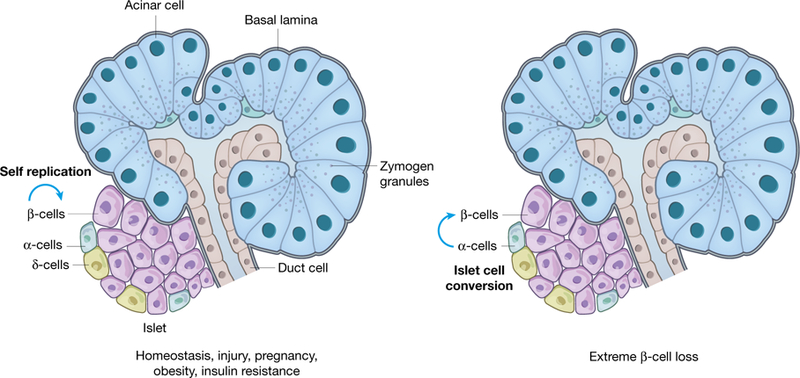
Fig 1. Naturalne regeneracyjne odpowiedzi trzustki endokrynnej.
Dorosła trzustka endokrynna (wyspy Langerhansa) składa się z czterech głównych typów komórek endokrynnych, z których każdy wydziela główny hormon: insulinę (komórki β), glukagon (komórki α), somatostatynę (komórki δ) i polipeptyd trzustkowy (komórki PP). Badania na zwierzętach wykazały, że replikacja komórek β jest głównym trybem regeneracji i naprawy w homeostazie, uszkodzeniach, ciąży, otyłości i oporności na insulinę. Przemiana komórek δ- i α-wyspy w komórki β została zgłoszona po skrajnej utracie komórek β za pomocą określonych metod ablacjii w modelach zwierzęcych. Istotna regeneracja trzustki endokrynnej jest głównie ograniczona do małych dzieci i młodych zwierząt. Dorosłe zwierzęta i ludzie dorosli mają niewielką, jeśli w ogóle, zdolność do regeneracji trzustki endokrynnej.
Komórki α- i δ-mogą przekształcać się w komórki β Pięć głównych typów komórek wyspy, tj. β-, α-, δ-, PP i ε-komórki, wydaje się być bardzo stabilnych w normalnej homeostazie lub w różnych modelach uszkodzeń. Na przykład selektywna ablacja komórek β za pomocą STZ lub alloxanu nie wpływa istotnie na liczbę ani fenotypy innych komórek wyspy. Było zaskoczeniem, że przy użyciu metody ablacji komórek β opartej na toksynie błoniczej do ablacji ponad 99% komórek β u myszy, zgłoszono powolną, ale znaczącą regenerację masy komórkowej β przez kilka miesięcy. Badania śledzenia linii sugerują, że nowe komórki produkujące insulinę powstawały z przekształcenia komórek trzustkowych α- lub δ, w zależności od wieku myszy. Molekularny mechanizm tego przekształcenia między rodzajami komórek wyspy jest nieznany, podobnie jak to, czy takie przekształcenia występują także u ludzi. Nie ma jednoznacznych dowodów na ten rodzaj przekształcenia u pacjentów z T1D, ale może to wynikać z tego, że nie występuje, albo też przekształcone komórki są eliminowane przez trwający proces autoimmunizacyjny. Niemniej jednak te badania sugerują inny mechanizm, który potencjalnie może zregenerować część kompartmentu endokrynnego (Fig. 1).
Poszukiwanie komórek macierzystych trzustki u dorosłych Istnieje długoletnia hipoteza, że w trzustce dorosłego zwierzęcia lub nawet człowieka mogą istnieć komórki macierzyste lub progenitorowe. Hipoteza ta opierała się początkowo na obserwacjach histologicznych pojedynczych komórek wyspy i małych wysp osadzonych w lub blisko związanych z przewodami trzustkowymi u dorosłych gryzoni i ludzi, co sugeruje pojawianie się nowych komórek wyspy z przewodów (zwane neogenezą). Jednak badania śledzenia linii genetycznych przy użyciu nośników egzokrynnych (Muc1-CreER), nośników acynarnych (Cela-CreER, Ptf1a-CreER) i nośników przewodów (Sox9-CreER, Hnf1b-CreER) konsekwentnie wskazały na rzadki lub brak udziału egzokryn w komórki endokrynnej podczas normalnej homeostazy lub w różnych modelach uszkodzeń. Hipotezę o neogenezie poparło doniesienie, że po podwiązaniu przewodów trzustkowych u myszy pojawiła się rzadka populacja komórek prekursorowych endokrynnych NGN3+ w strukturach przewodowych, a obserwacje komórek NGN3+ wokół wysp i przewodów w modelach doświadczalnych transdyferencjacji komórek α- na komórki β41,42. Podsumowując, wciąż nie wiadomo, czy istnieją komórki macierzyste trzustki u dorosłych.
Przejdź do: Regeneracja trzustki zewnątrzwydzielniczej Trzustka zewnątrzwydzielnicza składa się z komórek acynarnych i komórek przewodowych. Najczęstszym uszkodzeniem trzustki zewnątrzwydzielniczej jest zapalenie trzustki, bolesne zapalenie wywołane różnymi czynnikami środowiskowymi (urazy, alkohol, dieta wysokotłuszczowa itp.) lub genetycznymi (na przykład mukowiscydoza)43. Zrozumienie uszkodzeń i regeneracji zewnątrzwydzielniczej pochodzi głównie z badań na gryzoniach nad doświadczalnym zapaleniem trzustki, najczęstszym z nich jest nadmierna stymulacja wydzielania komórek acynarnych za pomocą ceeruleiny, mysiego analogu hormonu cholecystokininy44,45. Leczenie ceeruleiną prowadzi do szybkiej apoptozy lub martwicy komórek acynarnych, a ponadto niektóre komórki acynarne tracą swoje liczne ziarnistości zymogenu i kurczą się znacznie, przypominając komórki przewodu w procesie zwanym metaplazją acynarowo-przewodową46. Zwierzęta szybko dochodzą do siebie po ostrym zapaleniu trzustki. W ciągu kilku tygodni trzustka zewnątrzwydzielnicza odzyskuje w pełni normalną architekturę komórkową i funkcję. Badania nad ludzkimi tkankami zewnątrzwydzielniczymi od pacjentów z zapaleniem trzustki również pokazują metaplazję przewodową i proliferację komórkową47,48. Chociaż pacjenci z ostrym zapaleniem trzustki mogą całkowicie wyzdrowieć, nie wiadomo, czy ich trzustka zewnątrzwydzielnicza podlega podobnej spontanicznej naprawie i regeneracji, jak to widziano u zwierząt modelowych.
Zaproponowano dwa odrębne tryby regeneracji w modelach zapalenia trzustki49 (Fig. 2). W klasycznym trybie regeneracji nowe komórki acynarne powstają z proliferacji istniejących już komórek acynarnych35,50,51. W drugim trybie regeneracji uważa się, że degranulowane i przypominające komórki przewodu komórki acynarne „redyferencjonują się” i powracają do normalnego i funkcjonalnego stanu acynarnego. Stan zdedyferyzowane komórek acynarnych nie został śledzony znacznikiem linii, a ich redyferencjacja została wywnioskowana za pośrednictwem środków pośrednich. Badania mechanizmów w modelach zwierzęcych zidentyfikowały kilka genów i szlaków wymaganych do odpowiedzi regeneracyjnej zewnątrzwydzielniczej w zapaleniu trzustki52–54, podobnie jak usunięcie kluczowych składników szlaku Hedgehog, Notch i Wnt z komórek acynarnych powoduje poważne zakłócenie regeneracji zewnątrzwydzielniczej55,56. Stan zdedyferyzowany komórek acynarnych wydaje się stanowić podatność, w której czynniki środowiskowe i genetyczne mogą działać wspólnie, aby indukować transformację nowotworową w kierunku śmiertelnych nowotworów trzustki57,58. Mechanizmy kontrolujące regenerację w porównaniu z transformacją nowotworową nie są jeszcze zrozumiane.
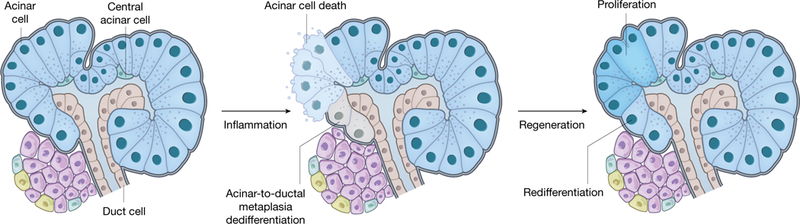
Fig 2. Regeneracja trzustki zewnątrzwydzielniczej
Trzustka zewnątrzwydzielnicza składa się z komórek acynarnych, które syntezują i wydzielają enzymy trawienne, komórek przewodowych, które kierują enzymy do jelita cienkiego, oraz centralnych komórek acynarnych. Trzustka zewnątrzwydzielnicza może regenerować się spontanicznie i skutecznie zarówno u zwierząt, jak i u ludzi. Uszkodzenia zapalne trzustki zewnątrzwydzielniczej, takie jak ostre zapalenie trzustki, prowadzą do śmierci komórek acynarnych i dedyferencjacji acynarów, co charakteryzuje się degranulacją i morfologiczną transformacją w komórki przypominające przewody, w procesie zwanym metaplazją acynarowo-przewodową. Po ustąpieniu zapalenia komórki acynarne mogą szybko regenerować się poprzez samoreplikację i możliwą redyferencjację metaplastycznych komórek przypominających przewody z powrotem do normalnego i funkcjonalnego stanu acynarnego.
Strategie wytwarzania nowych komórek wysp endokrynnych Podczas gdy dorosłe trzustki myszy wykazują silną zdolność do regeneracji w odpowiedzi na wyzwania fizjologiczne, takie jak otyłość, insulinooporność czy ciąża, nie jest pewne, czy dorosła trzustka człowieka może uruchomić adaptacyjną reakcję regeneracyjną, a nawet jeśli tak, te reakcje wyraźnie nie są w stanie wywrzeć istotnego wpływu fizjologicznego. Jednocześnie kliniczna potrzeba terapii regeneracji komórek β jest ogromna. Około 2,5 miliona ludzi w USA (i ponad 20 milionów na całym świecie) cierpi na cukrzycę typu 1 (T1D), a wielu milionów pacjentów z cukrzycą typu 2 (T2D) ma niedobór komórek β trzustki. Obydwie grupy pacjentów mogłyby skorzystać z terapii przywracających funkcjonalną masę komórek β, uwalniając ich od codziennych zastrzyków insuliny i unikając poważnych powikłań wynikających z niedokładnego dawkowania. Potrzeba regeneracji komórek β u pacjentów z T1D jest szczególnie paląca, ponieważ ta choroba dotyka głównie dzieci, a drastyczny niedobór komórek β w T1D może powodować groźne fluktuacje glukozy we krwi59,60.
Dziesięciolecia badań klinicznych wykazały, że przeszczep komórek wysp trzustkowych od zmarłego dawcy może przynieść korzyści pacjentom z T1D, przy czym niektórzy pacjenci pozostają wolni od stosowania insuliny przez lata61,62. Niemniej jednak kliniczny przeszczep komórek wysp od zmarłego dawcy jest stosowany tylko w niewielkiej skali z powodu braku odpowiednich komórek wysp od zmarłego dawcy i konieczności długotrwałego stosowania immunosupresji w celu zwalczania auto- i alloimmunologii. Aby leczyć większe grupy pacjentów, korzystne byłoby posiadanie niezawodnego i standaryzowanego źródła komórek wysp od zmarłego dawcy, najlepiej bez konieczności stosowania immunosupresji. Alternatywnie można byłoby zastosować interwencje terapeutyczne stymulujące regenerację endogennych wysp trzustkowych. W odpowiedzi na ogromne niespełnione potrzeby medyczne prowadzone są obecnie liczne badania w celu oceny strategii wytwarzania nowych wysp in vitro lub stymulowania regeneracji wysp in vivo (Fig. 3).
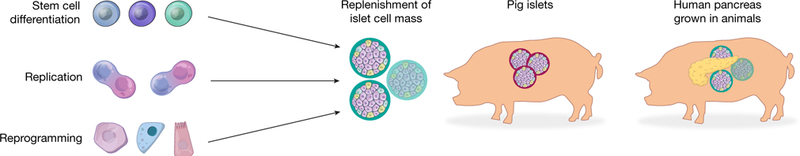
Fig 3. Strategie terapeutyczne w regeneracji i naprawie trzustki endokrynnej.
Obecnie najbardziej zaawansowaną technologią wytwarzania funkcjonalnych ludzkich komórek wydzielających insulinę, jedyną również poddaną badaniom klinicznym, jest uzyskiwanie ich z ludzkich pluripotencjalnych komórek macierzystych. Inne strategie obejmują stymulowanie proliferacji pozostałych komórek β in vivo, reprogramowanie komórek nie-β na komórki przypominające β in vivo lub in vitro, pozyskiwanie wysp od genetycznie zmodyfikowanych świń, a także potencjalnie hodowanie całych ludzkich trzustek w zwierzętach, po czym usuwanie komórek wysp do przeszczepu.
Dziesięciolecia badań rozwojowych prowadzonych na żabach, rybach i myszach pozwoliły zmapować kluczowe etapy i krytyczne zdarzenia sygnalizacyjne prowadzące od zapłodnionej komórki do powstania dojrzałych wysp trzustkowych we wczesnym dzieciństwie63–65. To głębokie zrozumienie rozwoju trzustki zostało wykorzystane w medycynie regeneracyjnej w 1998 roku, gdy po raz pierwszy udało się hodować ludzkie komórki macierzyste zarodkowe (hES), co otworzyło drogę do opracowania metod pozyskiwania wysp trzustkowych z hES66. Ten postęp został następnie podtrzymany w 2006 roku odkryciem, że można uzyskać indukowane komórki pluripotencjalne (iPS) z komórek somatycznych, takich jak fibroblasty skórne, co stworzyło możliwość generowania komórek specyficznych dla pacjenta67.
W pierwszych głównych badaniach dotyczących pozyskiwania komórek trzustkowych z hES opracowano protokół stopniowego różnicowania, wykorzystując kombinacje cząsteczek sygnałowych, aby naprowadzić różnicowanie hES przez cztery kolejne etapy (definitywny endoderm, nabłonek trzustkowy, progenitory endokrynne i komórki przypominające β)68,69. Pierwsze różnicowania komórek macierzystych człowieka w komórki wyspowe skutkowały populacją komórek o mieszanym wyrażeniu hormonów, ale nie dojrzałymi lub prawdziwymi komórkami β68. Te badania, w połączeniu z dziesięcioleciami badań nad rozwojem trzustki w modelach zwierzęcych, stworzyły szablon protokołów różnicowania in vitro, które zostały zastosowane do komórek pluripotencjalnych.
W ostatnim czasie prace badawcze skierowano na produkcję wysp endokrynnych, które mogą reagować na glukozę. Opracowano bardziej skomplikowane protokoły różnicowania, z dodatkowymi etapami, zoptymalizowanymi koktajlami czynników indukujących i substancji chemicznych oraz stosując trójwymiarowe metody hodowli, które dają klastry komórkowe o znacznej morfologicznej i funkcjonalnej podobieństwo do wysp trzustkowych70,71. Przeszczep tych w komórkach wyhodowanych skupiskach komórkowych prowadził do dalszej funkcjonalnej dojrzałości in vivo i skutecznej odbudowy doświadczalnego cukrzycy w modelach mysich70,71.
Oprócz wysp endokrynnych, pojawiły się komórkowe progenitory trzustki, z których niektóre mają zdolność do produkcji dojrzałych komórek produkujących hormony69. Badania przedkliniczne wykazały, że gdy progenitory PDX1+ wyhodowane z komórek hES zostały przeszczepione do myszy, niektóre z tych komórek uległy wzrostowi i różnicowaniu in vivo w funkcjonalne komórki β, które mogą odwrócić cukrzycę69,72. Te postępy doprowadziły do badań klinicznych fazy I i II progenitorów trzustki. Klastery komórkowe wysp, bardziej w pełni zróżnicowane i funkcjonalne, mają wkrótce wziąć udział w badaniach klinicznych. W obu podejściach wyhodowane in vitro klastry komórkowe zawierają zarówno komórki β, jak i inne rodzaje komórek wysp (komórki α i δ), które są znane z dostosowywania funkcji komórek β. W naturalnych wyspach znajdują się również dodatkowe rodzaje komórek, takie jak komórki naczyniowe i komórki podobne do fibroblastów, a włączenie tych dodatkowych komórek do klastrów do przeszczepu może przynieść pewne korzyści.
Mimo znacznych postępów w uzyskiwaniu komórek endokrynnych trzustki z hES, istnieją istotne wyzwania. Obejmują one doskonalenie protokołów różnicowania dla produkcji w dużej skali, eliminowanie niechcianych komórek z końcowego produktu i oczywiście zabezpieczenie przed odrzutem immunologicznym. Zarówno odrzuty allo-, jak i autoimmunologiczne można w zasadzie uniknąć poprzez fizyczną ochronę w małym urządzeniu, na przykład w osłonce z alginianu lub bardziej trwałego biomateriału. Alternatywnie możliwe byłoby zmniejszenie ataku immunologicznego poprzez modyfikację genetyczną przeszczepianych komórek i/lub manipulowanie układem immunologicznym biorcy.
Produkty komórkowe specyficzne dla pacjenta można uzyskać z komórek iPS, co powinno unikać odrzutu immunologicznego i być immunologicznie zgodnym z pacjentem, od którego pochodziła komórka iPS. Jest to oczywiście głównie istotne dla zastępowania komórek β u pacjentów z T2D, ponieważ pacjenci z T1D cierpią z powodu autoimmunizacji. Jednakże wytwarzanie produktów specyficznych dla pacjenta stawia przed nami własne wyzwania, ponieważ będzie wymagało optymalizacji warunków różnicowania dla każdej partii komórek iPS, co wprowadzi znaczne koszty i obciążenie operacyjne w procesie.
Potencjalnie istotny postęp pochodzi z badań przesiewowych substancji chemicznych, które zidentyfikowały inhibitory kinazy DYRK1A (kinaza regulowana podwójną fosforylacją tyrozyny 1A) jako środki, które potrafią skutecznie pobudzać proliferację hodowanych komórek β człowieka in vitro oraz przeszczepionych komórek β człowieka in vivo. To stanowi pierwszy konkretowy molekularny cel do manipulacji proliferacją komórek β człowieka94–96. Ponadto identyfikowane są inne szlaki biorące udział w proliferacji komórek β człowieka, takie jak kalcyneuryna i SerpinB197,98. Aby wprowadzić te substancje do klinik, konieczne będzie kontrolowanie specyficzności komórek, ukierunkowywanie interwencji na wyspy trzustkowe i zapewnienie, że substancje wpływające na konserwowane machiny cyklu komórkowego nie powodują problemu tworzenia nowotworów.
Reprogramowanie komórek nie-β w komórki przypominające β Obserwacje rzadkich zdarzeń zmiany losu komórkowego w rozwoju sięgają wielu dziesięcioleci99. W dobrze udokumentowanym przykładzie regeneracji soczewki u traszki, usunięcie soczewki prowadzi do proliferacji nabłonkowych komórek barwnikowych otaczających soczewkę i odtworzenia nowej soczewki100. Badania molekularne regulatorów podstawowych linii komórkowych, takich jak MYOD, dodatkowo utrwaliły przekonanie, że potężne czynniki genetyczne mogą dyktować wybory losu komórkowego101. I jądrowy transfer komórkowy wykazał potencjał do reprogramowania praktycznie każdego jądra do innego stanu komórkowego102. W związku z tym istnieje duże zainteresowanie wykorzystaniem głównych regulatorów rozwoju komórek β do przekształcania komórek nie-β w komórki produkujące insulinę. Wczesnym przykładem jest indukcja ekspresji insuliny z komórek wątroby myszy103. Inne badania potwierdziły, że ekspresję insuliny można indukować w komórkach nie-β, ale te komórki nie przyjmują morfologicznych, molekularnych i funkcjonalnych cech komórek β trzustki i nie są reprogramowane do stanu komórki przypominającej β104–108.
Strategia przesiewowego skojarzenia pokazała, że kombinacja trzech regulatorów rozwoju komórek β, NGN3, PDX1 i MAFA (określanych jako czynniki NPM), mogła skutecznie przekształcać komórki zrazikowe trzustki w komórki przypominające β po dostarczeniu ich do trzustki myszy dorosłej przy użyciu wektorów adenowirusowych109. Wprowadzone komórki przypominające β osiągnęły długotrwałą stabilność i zdolność do odwracania cukrzycy110. Dalsze badania zidentyfikowały komórki nabłonkowe przewodu pokarmowego jako inny rodzaj komórek, który mógłby zostać przekształcony w komórki przypominające β111. Komórki z żołądka odźwiernika wydają się być szczególnie podatne na takie przekształcenie112. W osobnym badaniu warunkowa delecja FOXO1 z prekursorów endokrynnych komórek jelita cienkiego (NGN3+) także doprowadziła do powstania komórek produkujących insulinę w jelitach113. Te badania razem sugerują, że komórki nabłonkowe przewodu pokarmowego są potencjalnym źródłem funkcjonalnych komórek wydzielających insulinę przez reprogramowanie. Inne przykłady reprogramowania komórek myszy obejmują cytokinami indukowaną konwersję komórek zrazikowych w komórki wydzielające insulinę, konwersję komórek przewodów w komórki wydzielające insulinę przez usunięcie FBW7 oraz konwersję hepatocytów w komórki produkujące insulinę przez TGIF2114–116.
Skrajna utrata komórek β może wywołać spontaniczną konwersję komórek δ- i α-trzustki w komórki β32,33. Chociaż molekularne mechanizmy tych zdarzeń konwersji pozostają nieznane, genetyczne usuwanie ARX, regulatora rozwoju komórek α, lub przymusowa ekspresja PAX4, regulatora rozwoju komórek β, może przekształcić komórki α w komórki β w modelach mysich117,118. Ostatnio zaproponowano, że unikalna populacja komórek produkujących insulinę na obrzeżach wysp może stanowić ogniwo pośredniczące w przejściu od komórek α do komórek β119. Dalsze badania zidentyfikowały sygnalizację kwasu γ-aminomasłowego (GABA) jako potencjalny ułatwiacz proces reprogramowania. Długotrwałe leczenie GABA u myszy prowadziło do imponującego zwiększenia masy komórek β42.
Mimo dowodów koncepcyjnych na reprogramowanie komórek β w modelach zwierzęcych, próby reprogramowania komórek ludzkich były mniej udane. Kilka badań sugeruje, że komórki α trzustki u ludzi mogą ulegać reprogramowaniu w komórki β42,120. Zmiany w stosunku komórek α do β i pojawienie się komórek dodatnich zarówno dla glukagonu, jak i insuliny dostarczyły pewnych dowodów na takie konwersje; jednak w braku śledzenia linii komórkowej brakuje bezpośrednich dowodów. Inne rodzaje komórek, takie jak komórki zrazikowe trzustki, komórki przewodowe, komórki pęcherzyka żółciowego i komórki jelita, również zostały użyte do generowania komórek wydzielających insulinę, ale te komórki nie tworzyły stabilnych przeszczepów po przeszczepieniu, sugerując niepełne przekształcenie losu komórkowego lub niestabilny stan epigenetyczny121–124. W tym momencie głównym wyzwaniem przy tłumaczeniu tej metody do kliniki jest określenie niezawodnych metod efektywnej produkcji ludzkich komórek przypominających β, które mogą rozwijać się w stabilne i funkcjonalne przeszczepy. Oprócz metody reprogramowania in vitro, reprogramowanie in vivo u pacjentów ludzkich, celujące w komórki α trzustki, komórki zrazikowe lub nabłonkowe komórki przewodu pokarmowego, może również być możliwe. Jednak optymalizacja protokołów reprogramowania in vivo do terapeutycznego zastosowania u ludzi będzie wyzwaniem.
Wieloletnie zainteresowanie budzi xenotransplantacja wysp trzustkowych, a kilka eksploracyjnych badań klinicznych xenotransplantacji z użyciem wysp trzustkowych świń przeprowadzono dziesięciolecia temu125–127. Jednakże silna reakcja immunologiczna na materiał xenogeniczny przez ludzki układ immunologiczny i obecność dużej liczby świniowych retrowirusów, które mogą przenosić się między gatunkami, stanowią istotne przeszkody. Ostatnie postępy w dziedzinie inżynierii genetycznej skłoniły do ponownego rozważenia możliwości użycia narządów hodowanych w świnach. Z użyciem technologii CRISPR–Cas9 zdeletowano pulę 62 znanych retrowirusów świń z komórek skóry świń128,129, które w zasadzie mogą być używane do uzyskiwania komórek iPS świń, a następnie genetycznie „czystych” świń jako dawców wysp. Przyszłe kliniczne zastosowanie wysp świń zależeć będzie od postępującej technologii kapsułkowania, która chroniłaby komórki przed reakcjami immunologicznymi człowieka, jednocześnie zapewniając długotrwałe przetrwanie i funkcjonalność.
Hodowla ludzkich tkanek trzustkowych w ciałach zwierząt Pomysł hodowli ludzkich organów w zwierzętach w celach terapeutycznych może wydawać się futurystyczny. Jednak postępy w dziedzinie technologii komórkowych i identyfikacja regulatorów głównych procesów formowania organów pobudziły badania nad tym pomysłem przy użyciu modeli zwierzęcych130–132. Na przykład, genetyczne usunięcie PDX1 u szczurów prowadzi do specificznej utraty całej trzustki z powodu niepowodzenia w utworzeniu trzustki embrionalnej. Wstrzyknięcie mysich komórek zarodkowych do blastocyst szczura Pdx1−/− stworzyło zwierzęta chimeryczne mysz-szczur, w których wszystkie organy składały się z mieszanki komórek myszy i szczura, z wyjątkiem trzustki, która pochodziła od komórek myszy. W ten sposób trzustka mysia była hodowana w ciele szczura. Mysie wyspy z tych szczurów można było pozyskać i przeszczepić z powrotem do myszy z cukrzycą, co skutkowało wyleczeniem jej cukrzycy132. To eksperyment na dowód koncepcji między dwoma różnymi gatunkami gryzoni dało wgląd w to, co przyszłość może przynieść w hodowli ludzkich organów w gatunkach zwierząt. Niemniej jednak ten pomysł jest wciąż w powijakach. Wstępne badania sugerują, że standardowe komórki hES nie mogą istotnie przyczyniać się do chimer w zwierzętach133. Dalsze zrozumienie mechanizmów może prowadzić do opracowania nowych metod redukcji niezgodności gatunkowej i podejść, które minimalizują lub eliminują niekontrolowany wkład komórek ludzkich do zwierząt chimerycznych. Oprócz tych wyzwań technologicznych, prawdopodobnie będzie konieczna zgoda społeczeństwa, aby przenieść tę technologię w kierunku klinicznego zastosowania.
Redyferencjacja komórek β Komórki β trzustki stają się dysfunkcyjne pod wpływem różnych warunków stresu, takich jak przedłużona hiperglikemia i hiperlipidemia (T2D), zapalenie trzustki z powodu przewlekłego zapalenia trzustki lub nowotworów trzustki (cukrzyca typu 3c) lub zapalenie autoimmunologiczne (T1D). Silny stres może prowadzić do degranulacji komórek β i obniżenia ekspresji genów komórek β. Ostatnie badania sugerują, że utrata właściwości komórek β może oznaczać dedyferencjację, charakteryzowaną zwiększeniem ekspresji genów, które są typowe dla embrionalnych prekursorów wysp (takich jak Neurog3)134. Niejasne jest, czy dedyferencjacja jest powszechną cechą dysfunkcyjnych komórek β i czy proces dedyferencjacji, jeśli istnieje u ludzi, może być odwrócony. Wiemy jednak, że dysfunkcyjne komórki β mogą się regenerować u pacjentów z T2D dzięki odpowiedniemu zarządzaniu, takiemu jak dieta, aktywność fizyczna czy intensywna terapia insulinowa. Jeśli można znaleźć farmakologiczne środki do „redefeferencji” zdedyferencjowanych komórek β, mogą stanowić one nowe podejście terapeutyczne w leczeniu cukrzycy i mogą być postrzegane jako odrębna forma terapii regeneracyjnej, która nie obejmuje bezpośrednio tworzenia nowych komórek135. Ta terapia byłaby najbardziej istotna dla T2D, ale teoretycznie mogłaby być pomocna także we wczesnym stadium T1D.
Wyzwania związane z opracowaniem terapii komórkowej dla T1D Opracowywanie produktów komórkowych do leczenia T1D wiąże się z unikalnym wyzwaniem autoimmunologicznym59,136. Aby chronić nowe komórki β, można używać immunosupresantów, standardowego leczenia pacjentów z T1D, którzy otrzymują przeszczepy wysp trzustkowych zmarłego dawcy. Niemniej wiele z tych leków jest znane ze swojej toksyczności dla komórek β, nie mówiąc już o zmniejszaniu zdolności immunologicznej pacjenta. Alternatywnym sposobem ochrony przeszczepionych komórek β jest kapsułkowanie za pomocą zmodyfikowanych materiałów. Kapsułkowanie fizycznie oddziela komórki β od komórek immunologicznych, ale również oddziela komórki β od naczyń krwionośnych, co zmienia kinetykę czujników glukozy oraz dostarczania tlenu i substancji odżywczych, co potencjalnie zagraża przetrwaniu i funkcji kapsułkowanych komórek. Opracowywane są innowacyjne materiały kapsułkujące w celu rozwiązania tych problemów137–140. Alternatywnym sposobem ochrony komórek β u pacjentów z T1D jest modyfikacja układu immunologicznego. Różne reżimy immunoterapii wykazały, że mogą osłabić lub nawet całkowicie zatrzymać ataki autoimmunologiczne w modelu myszy nieotyłej (NOD)141–143. Niestety w badaniach klinicznych te leki nie wykazały istotnej korzyści dla pacjentów.
Aktualne terapie komórkowe dla T1D wymagają użycia urządzeń kapsułkujących lub środków immunosupresyjnych, co wiąże się z wadami i ryzykiem. Patrząc w przyszłość, idealne byłoby znalezienie sposobów na uzyskanie wysp, które naturalnie opierają się autoimmunizacji. Jak można to osiągnąć? Jednym ważnym wskazówką są badania nad pacjentami z długotrwałą cukrzycą typu 1 (takimi jak badanie Joslin Medalist), które wykazały zaskakujące odkrycie, że znaczna liczba tych pacjentów ma wykrywalną produkcję insuliny z zachowaniem responsywności na glukozę, co sugeruje, że niektóre komórki β mogą unikać autoimmunizacji i nadal funkcjonować144,145. Inna możliwość to ciągła produkcja nowych komórek β u niektórych pacjentów. Atak autoimmunizacyjny w trzustce nie jest jednorodny. Raczej obserwowano, że niektóre wyspy lub nawet całe płaty trzustki uchodzą przed zniszczeniem przez układ immunologiczny, podczas gdy są otoczone płatami pozbawionymi komórek β60. Te dane sugerują, że komórki β u ludzi mogą być heterogeniczne i że subpopulacja komórek β może opierać się atakowi autoimmunologicznemu. Te obserwacje kliniczne są zgodne z rosnącymi dowodami na to, że komórki β u myszy i ludzi w normalnych wyspach są heterogeniczne pod względem swojego sygnatury molekularnej lub potencjału proliferacyjnego146–148. Przedstawiono także propozycję, że podzbiór komórek β może pełnić rolę „węzłów” inicjujących pulsacyjne uwalnianie insuliny149. Obecnie nie wiadomo, czy komórki β znalezione u pacjentów z T1D są nowo utworzone w odpowiedzi na autoimmunizację, czy też z jakiegoś powodu są odporne na eliminację przez układ immunologiczny. Skoncentrowane badania tych komórek β w próbkach ludzkich i głębsze zrozumienie heterogeniczności komórek β u ludzi mogą w końcu dostarczyć celów molekularnych, które umożliwią produkcję funkcjonalnych komórek wydzielających insulinę, które opierają się autoimmunizacji. Komórki β pochodzące z reprogramowania komórek α wykazały oporność na autoimmunizację w badaniach na myszach, co stanowi kolejną potencjalną ścieżkę do badania i ewentualnie produkcji komórek β odporne na autoimmunizację120. Wreszcie, możliwe może być genetyczne modyfikowanie komórek β w taki sposób, aby były w stanie uniknąć wykrycia lub eliminacji przez komórki autoimmunologiczne.
Nabraliśmy dużo wiedzy na temat rozwoju trzustki w okresie embrionalnym oraz różnych reakcji regeneracyjnych, jakie trzustka podejmuje w odpowiedzi na wyzwania fizjologiczne i urazy. Te spostrzeżenia są teraz wykorzystywane do opracowywania strategii regeneracyjnych poprzez różnicowanie komórek macierzystych, reprogramowanie komórek nie-β i inne podejścia. Badania podstawowe nad rozwojem i homeostazą trzustki będą nadal dostarczać nowych spostrzeżeń, które zainspirują alternatywne strategie terapeutyczne. Na przykład badania nad formowaniem wysp trzustkowych w okresie embrionalnym mogą pomóc doskonalić protokoły różnicowania komórek hES w 3D skupiska wysp; głębsze zrozumienie tego, w jaki sposób wyspy przechodzą od stanu niedojrzałego do dojrzałego w okresie poporodowym, powinno ułatwić wysiłki w produkcji dojrzałych funkcjonalnie komórek β in vitro; badania sygnałów, które przekształcają fizjologiczną ekspansję masy komórek β w otyłości i insulinooporności, mogą prowadzić do nowych substancji stymulujących proliferację komórek β bez znaczącego ryzyka wystąpienia nowotworów.
Mimo znacznych postępów w naszym zrozumieniu regeneracji trzustki, pozostają kluczowe pytania. Wystarczająco przekonujące dowody na istnienie komórek macierzystych w dorosłej trzustce? Jak heterogeniczne są komórki β trzustki pod względem funkcji i właściwości immunologicznych? Jakie mechanizmy używa ludzka trzustka do naturalnej regeneracji i naprawy? Aby odpowiedzieć na te pytania, różnorodne systemy modelowe, w tym gryzonie, danio pręgowane, duże zwierzęta, naczelne i inne, prawdopodobnie będą pouczające. Nowe technologie odegrają ważną rolę w posuwaniu tych badań naprzód. Analiza pojedynczych komórek dostarczy niezrównanego spojrzenia na zróżnicowanie normalnych i chorych komórek wysp, uchwyci rzadkie komórki istotne dla regeneracji endokrynnej lub oporności immunologicznej, i zdefiniuje stany przejściowe od komórek hES do dojrzałych komórek β lub od komórek nie-β do komórek przypominających β; obrazowanie komórek na żywo na poziomie pojedynczych komórek umożliwi bezpośrednią wizualizację fal wapniowych, uwalniania insuliny i interakcji immunologicznych w nietkniętych wyspach in vivo; modele myszy z ludzkimi komórkami i ludzkie organoidy mogą pełnić rolę zastępczą do badania biologii ludzkiej trzustki; a badania genetyczne u ludzi i technologia CRISPR–Cas mogą prowadzić do odkrycia nowych czynników w chorobie i regeneracji trzustki.
Rozpoczęły się już badania kliniczne produktów komórkowych wysp pochodzących od komórek hES. Inne podejścia, w tym proliferacja komórek β i reprogramowanie, także mogą osiągnąć etap rozwoju terapeutycznego. Każde z podejść oferuje pewne zalety (Tabela 1). Poza bezpieczeństwem i skutecznością tych produktów komórkowych, to, jak sobie poradzą w środowisku autoimmunizacji T1D, może być kluczowym wyznacznikiem ich sukcesu. Ponownie przypominamy sobie tutaj, że ostatecznym celem terapii T1D jest produkt komórkowy, który naturalnie opiera się autoimmunizacji i nie wymaga kapsułkowania ani immunosupresji. Bliska współpraca między immunologami a biologami komórek β będzie konieczna, aby osiągnąć terminowy postęp w realizacji tego celu, a jeśli nam się uda, korzyści z tego będą dotyczyć nie tylko pacjentów z T1D, ale także przyniosą istotne nauki dotyczące znalezienia lekarstw na wiele innych chorób autoimmunizacyjnych.
źródło: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6168194/
