Układ endokannabinoidowy (eCB) został dokładnie zbadany w celu zidentyfikowania struktur molekularnych obecnych w Cannabis sativa. eCB składa się z receptorów kannabinoidowych, endogennych ligandów i związanej z nimi aparatury enzymatycznej odpowiedzialnej za utrzymanie homeostazy energetycznej i procesów poznawczych. Kilka efektów fizjologicznych kannabinoidów jest wywieranych poprzez interakcje z różnymi receptorami, takimi jak receptory CB1 i CB2, receptory waniloidowe, a także niedawno odkryte receptory sprzężone z białkiem G (GPR55, GPR3, GPR6, GPR12 i GPR19). Anandamid (AEA) i 2-arachidonoylglicerol (2-AG), dwa małe lipidy pochodzące od kwasu arachidonowego, wykazały wysokie powinowactwo do receptorów CB1 i CB2. eCB odgrywa kluczową rolę w przewlekłym bólu i zaburzeniach nastroju, dlatego został szeroko zbadany ze względu na swoje szerokie potencjalne zastosowanie terapeutyczne i jako obiecujący cel dla rozwoju nowych leków. Fytokannabinoidy i kannabinoidy syntetyczne wykazały zróżnicowane powinowactwo do eCB i są istotne w leczeniu wielu chorób neurologicznych. Niniejsza recenzja opisuje składniki eCB i omawia, w jaki sposób fytokannabinoidy i inne związki egzogenne mogą regulować równowagę eCB. Ponadto przedstawiamy hipo- lub hiperfunkcjonalność eCB w organizmie oraz związki eCB z przewlekłym bólem i zaburzeniami nastroju, nawet przy zastosowaniu praktyk zdrowotnych zintegrowanych i uzupełniających (ICHP) harmonizujących eCB.
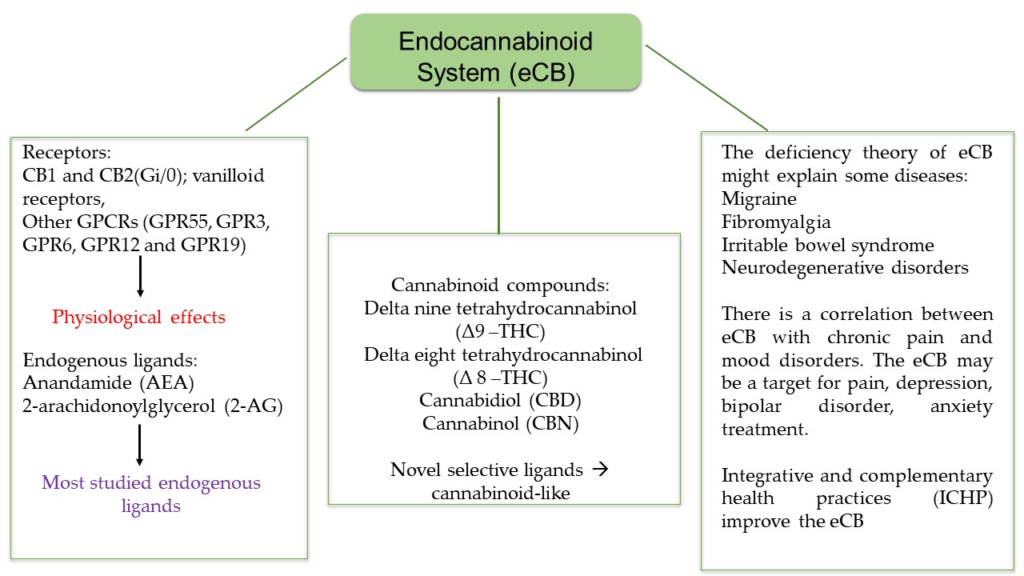
- Wprowadzenie Cannabis sativa jest używana do celów rekreacyjnych [1,2], terapeutycznych [3,4] oraz innych od tysięcy lat [5]. Roślina zawiera ponad 120 terpenów zwanych fitokannabinoidami, w tym jednego z głównych i najbardziej rozpoznawalnych przedstawicieli, Δ9-tetrahydrokannabinolu (THC). Strukturę molekularną Δ9-THC zidentyfikowano po raz pierwszy w 1964 roku, co prowadziło do przypuszczenia istnienia receptora kannabinoidowego i zwiększyło odkrywanie układu endokannabinoidowego (eCB), który głównie jest systemem międzykomórkowym odpowiedzialnym za homeostazę energetyczną i regulację spożycia pokarmu, metabolizmu i wydatków energetycznych, utrzymując stałą masę ciała [6]. Oprócz apetytu, eCB może przyczyniać się do procesów poznawczych związanych z pamięcią, nastrójem i bólem [7]. eCB zyskał na znaczeniu podczas pandemii COVID-19, nie tylko ze względu na hamowanie replikacji SARS-CoV-2, ale także w różnych badaniach obejmujących jego zastosowanie w leczeniu przewlekłego bólu i zaburzeń nastroju [8,9,10,11,12,13]. eCB to aktywny system, który pobudza złożoną sieć sygnalizacji komórkowej. Obejmuje on kombinację receptorów kannabinoidowych, endogennych kannabinoidów (endokannabinoidów) i enzymów odpowiedzialnych za syntezę i degradację endokannabinoidów. Pierwsze badania rozpoczęły się od identyfikacji receptorów o nazwach receptor kannabinoidowy typu 1 i 2, czyli CB1R i CB2R [14,15,16,17]. Ponadto dokonano odkrycia endogennych ligandów, co wzbogaciło naszą wiedzę o nowe związki, takie jak N-arachidonoyletanoloamid, pierwszą cząsteczkę endokannabinoidu odkrytą, nazwaną „anandamidem”, słowem sanskryckim oznaczającym „błogość” lub ekstremalne szczęście [18], a następnie zidentyfikowano 2-arachidonoyloglicerol (2-AG), które wraz z enzymami odpowiedzialnymi za syntezę i degradację tych związków stanowią to, co dzisiaj nazywamy układem endokannabinoidowym [19]. W październiku 2022 r. wyszukiwanie w bazie PubMed artykułów naukowych opublikowanych we wszystkich dostępnych okresach, zawierających słowo „Endocannabinoid”, wykazało 12 272 wyniki, zwiększające się zainteresowanie badaniami i publikacjami od roku 2000. Te liczby ilustrują szybko rosnące wsparcie finansowe w ostatnich latach oraz zainteresowanie naukowe zrozumieniem mechanizmów molekularnych w różnych kontekstach zastosowań klinicznych. Niniejsza recenzja skupia się na ostatnich postępach w zrozumieniu składników eCB i omawia role fitokannabinoidów, innych związków egzogennych, leczenie bólu i zaburzeń nastroju przy użyciu eCB, a także praktyki zdrowotne zintegrowane i uzupełniające.
- Receptory kannabinoidowe Receptory kannabinoidowe CB1/CB2 są głównie odróżniane przez sekwencję aminokwasów w łańcuchu polipeptydowym i przez ich rozmieszczenie w różnych tkankach [20,21,22,23] (Rysunek 1). Badania farmakologiczne sugerują, że cząsteczki kannabinoidowe mogą oddziaływać na receptory inne niż klasyczne receptory CB1 i CB2, takie jak receptory waniloidowe TRPV1, TRPV2, TRPV3, TRPV4, TRPA1, TRPM8 oraz receptory metabotropowe, takie jak GPR55, GPR3, GPR6, GPR12 i GPR19, między innymi receptory, a także enzymy i białka [24,25,26]. Ostatnio eCB został rozwinięty, a badacze nazwali go endokannabinoidom (eCBome), znaczącym odniesieniem obejmującym wszystkie składniki oraz białka, enzymy i lipidy, które bezpośrednio lub pośrednio uczestniczą w modulacji systemu kannabinoidowego i istotnie wpływają na zdrowie [27].
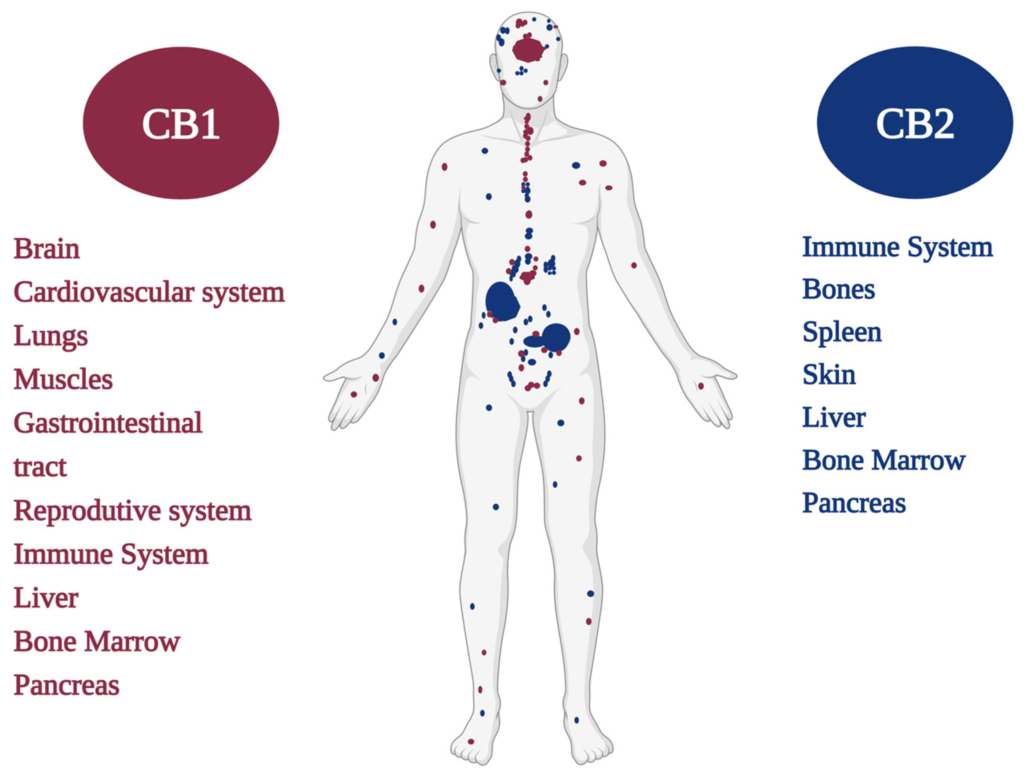
Rysunek 1. Receptory kannabinoidowe CB1 i CB2 oraz ich rozmieszczenie w ludzkim ciele.
Endogenny system sygnalizacji lipidowej może być głęboko zaangażowany w wiele stanów fizjologicznych i zaburzeń patologicznych, co może stanowić perspektywę dla przyszłego leczenia różnych chorób [28,29,30,31]. Fitokannabinoidy, takie jak kannabidiol (CBD), wykazują szerokie zastosowanie terapeutyczne, prawdopodobnie ze względu na zdolność do oddziaływania na liczne receptory. eCBome odgrywa rolę w osi mikrobiota-jelito-mózg, która stała się ważnym uczestnikiem kontroli funkcji afektywnych i poznawczych oraz ich zmian patologicznych. Jednak molekularne i biochemiczne podstawy interakcji oraz biologiczne zależności nowych podtypów receptorów z ligandami kannabinoidowymi nie zostały w pełni wyjaśnione; dlatego konieczne są dalsze badania [32,33,34]. Receptor kannabinoidowy typu 1 (CB1R) jest kodowany przez gen CNR1 [35,36] i został sklonowany u szczurów przez Matsudę i innych w 1990 roku [14]. Lata później CB1R został również sklonowany w ludzkich tkankach [37,38] oraz u myszy [39], wykazując 97–99% tożsamości sekwencji aminokwasów między tymi gatunkami [40]. Po sklonowaniu receptora możliwe było zaprojektowanie cząsteczek ligandów, które pasują do tych receptorów, stosując logikę modelu klucz-zamek [14,41,42,43]. Radioaktywny środek śledzący syntezowany przez Pfizer („CP55, 940”) umożliwił badaczom zmapowanie lokalizacji receptorów kannabinoidowych w mózgu. Receptory te zostały zidentyfikowane w ośrodkowym układzie nerwowym (OUN) i w wysokich stężeniach w regionach odpowiedzialnych za procesy psychiczne i fizjologiczne, takie jak hipokamp (pamięć), kora mózgowa (poznawczość), móżdżek (koordynacja ruchowa), jądra podstawy (ruch), podwzgórze (apetyt) i migdał (emocje) [35,44]. Receptory kannabinoidowe występują w mniejszej liczbie w jądrze mostowym, regionie kontrolującym oddychanie i akcję serca, co może wyjaśniać brak doniesień o zgonach z powodu przedawkowania Cannabis, niezależnie od wieku, celu klinicznego lub drogi podania [45,46]. CB1R jest również wyrażany w komórkach glejowych, oligodendrocytach i mikrogleju, które uczestniczą w przewodnictwie synaptycznym [46,48,49]. Dotychczasowe badania sugerują, że CB1R jest wysoce wyrażany w zakończeniach presynaptycznych i moduluje retrogradne sygnały endokannabinoidowe [50]. Jednak istnienie CB1R na miejscach postsynaptycznych nie zostało wykluczone, na przykład w badaniach funkcjonalnych wykazujących autoinhibicję neuronów korowych przez endokannabinoidy [51]. Badania dotyczące mapowania mózgu szczura sugerują, że preferowanym miejscem CB1R są aksony i zakończenia nerwowe, a jego działania związane są z regulacją uwalniania neurotransmiterów, takich jak noradrenalina, dopamina, acetylocholina, glutaminian, 5-hydroksytryptamina, kwas γ-aminomasłowy (GABA) i d-asparaginian [1,52,53]. CB1R jest obficie wyrażany także w obwodowym układzie nerwowym, jak i w innych obszarach ciała [54,55]. W układzie nerwowym obwodowym CB1R jest wysoce wyrażany w zakończeniach nerwów współczulnych. Ponadto CB1R występuje w zwojach trójdzielnych, zwojach korzeni tylnych i zakończeniach nerwów skórnych pierwszorzędowych neuronów czuciowych, gdzie reguluje nocicepcję włókien nerwowych aferentnych. W przewodzie pokarmowym (GIT) CB1R jest wyrażany zarówno w układzie nerwowym jelit, jak i w komórkach nie-nerwowych, takich jak błona śluzowa jelita, w tym komórki enteroendokrynne, komórki immunologiczne i enterocyty. CB1R reguluje ruchliwość GIT [56], wydzielanie kwasów żołądkowych [57], płynów [58], neurotransmiterów [59] i hormonów [60], a także przepuszczalność nabłonka jelitowego [61]. CB1R obecny w OUN odgrywa rolę w regulacji apetytu w podwzgórzu i reguluje bilans energetyczny oraz spożycie pokarmu w GIT. Co ciekawe, wątrobowe CB1R mogą również brać udział w regulacji bilansu energetycznego i metabolizmu [46,62,63]. Normalnie ekspresja CB1R w wątrobie jest bardzo niska; jednak w warunkach patologicznych ekspresja CB1R w różnych rodzajach komórek wątroby jest znacznie zwiększona, gdzie CB1R aktywnie przyczynia się do insulinooporności wątrobowej, włóknienia i lipogenezy. Podobnie CB1R jest regulowany w układzie sercowo-naczyniowym w warunkach patologicznych, co sprzyja postępowi choroby i dysfunkcji serca [55,64,65,66]. Aktywacja CB1R w kardiomiocytach, komórkach śródbłonka naczyń krwionośnych i komórkach mięśni gładkich prowadzi do stresu oksydacyjnego, stanu zapalnego i włóknienia. Oprócz wspomnianych tkanek, ekspresję CB1R stwierdzono także w tkance tłuszczowej, mięśniach szkieletowych, kościach, skórze, oczach, układzie rozrodczym oraz różnych typach komórek nowotworowych. W mięśniach szkieletowych i miokardium receptory CB1R są głównie zlokalizowane w mitochondriach (mtCB1R). Aktywacja receptorów mtCB1 może uczestniczyć w regulacji mitochondrialnej aktywności oksydacyjnej, prawdopodobnie poprzez istotne enzymy zaangażowane w metabolizm kwasu pirogronowego, głównego substratu dla aktywności cyklu trójkarboksylowego [23,67,68,69]. Receptor kannabinoidowy typu 2 (CB2R) został sklonowany w 1993 roku z komórek promielocytarnego białaczka ludzkiej linii HL-60 [15] i dalej zidentyfikowany u myszy, szczurów, ryb karpiowatych i psów [70,71,72,73]. Ma on sekwencję aminokwasów o około 44% homologii z resztami aminokwasów CB1R. CB2R znajduje się głównie w komórkach układu immunologicznego, gdzie poziomy jego ekspresji są wyższe niż CB1R [24,46,74]. CB2R reguluje komórki immunologiczne i przyczynia się do efektów analgetycznych i/lub przeciwnociceptywnych kannabinoidów. CB2R został zidentyfikowany także w OUN. Jednak niektóre badania wykazały jego obecność na powierzchni mikrogleju i neuronów zlokalizowanych w móżdżku, pniu mózgu, wzgórzu, jądrze prążkowania, korze, migdałach i hipokampie [46,75]. Zarówno CB1R, jak i CB2R należą do dużej rodziny receptorów sprzężonych z białkami G (GPCR). Są to białka błonowe zbudowane z aminokwasowego domeny ekstracellularnego, siedmiu konserwatywnych helis o charakterystycznej sekwencji 20–27 reszt aminokwasowych o wysokiej hydrofobowości, trzech pętli ekstracellularnych i trzech pętli intracellularnych oraz domeny karboksylowej końca wewnątrzkomórkowego [40,76] (Rysunek 2).
Rysunek 2. Ilustracja receptora należącego do dużej rodziny receptorów sprzężonych z białkami G (GPCR).
Aktywacja obu receptorów kannabinoidowych prowadzi do hamowania cyklazy adenylanowej w różnych typach komórek poprzez sprzężenie z białkiem Gi/o. To prowadzi do obniżenia poziomów 3′,5′-monofosforanu adenozyny (cAMP) i aktywności kinazy białkowej A (PKA), co może być związane z nadwrażliwością neuronów nociceptywnych oraz białkami, które mogą być związane z zwiększonym stężeniem wapnia wewnątrzkomórkowego, trifosforanem mioinozytolu i diacyloglicerolami, które ostatecznie są zaangażowane w modulację uwalniania neurotransmiterów [77,78]. Stymulacja CB1R prowadzi do aktywacji szlaku sygnałowego kinazy białkowej aktywowanej przez mitogen (MAPK), w tym kinazy regulowanej sygnałowo przez czynniki zewnętrzne 1/2 (ERK1/2), kinazy N-terminalnej c-Jun (JNK) i p38, które są zaangażowane w regulację proliferacji komórkowej, kontrolę cyklu komórkowego i śmierć komórkową [46,79] (Rysunek 3).
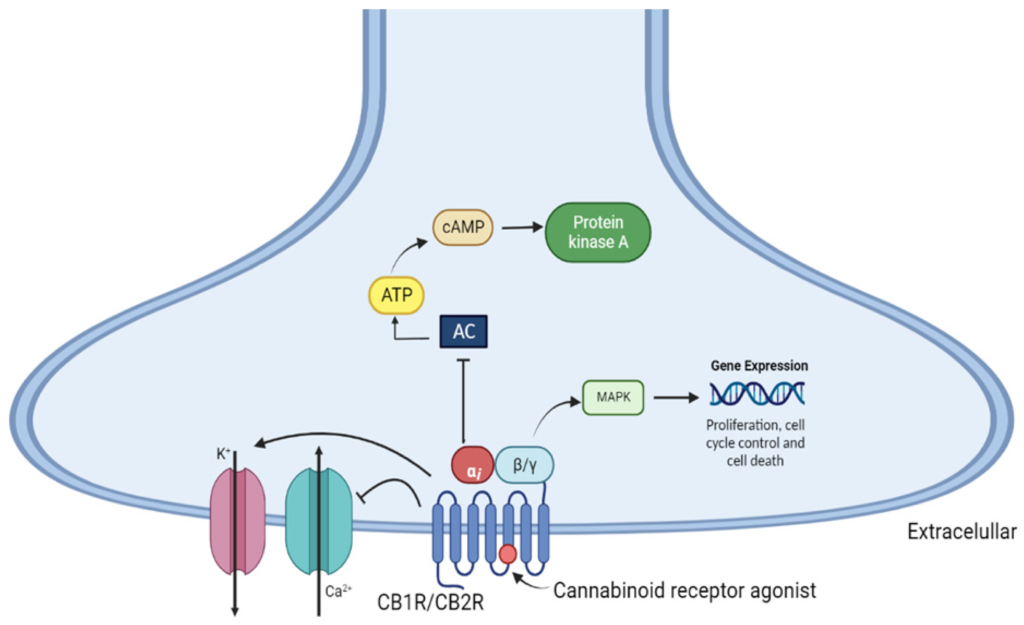
Rysunek 3. Mechanizm sygnalizacji wewnątrzkomórkowej poprzez aktywację receptorów kannabinoidowych CB1 i CB2. AC—cyklaza adenylanowa, cAMP—cykliczny monofosforan adenozyny; ATP—trifosforan adenozyny; MAPK—kinaza białkowa aktywowana przez mitogen; PKA—kinaza białkowa A.
- Endokannabinoidy: Synteza, uwalnianie i metabolizm Odkrycie receptorów kannabinoidowych wzbudziło zainteresowanie poszukiwaniem endogennych ligandów odpowiedzialnych za ich modulację. Ocena oczyszczonych frakcji mózgu świń doprowadziła do zidentyfikowania nowego związku, który wiąże się z receptorem CB1. Arachidonyletanolamid, pochodna kwasu arachidonowego w mózgu świń, został scharakteryzowany i nazwany anandamidem (AEA), słowem pochodzącym od sanskryckiego słowa „ananda”, oznaczającego skrajne szczęście [18,77,80,81,82].
Na podstawie rozwiązania struktury AEA zidentyfikowano inne endogenne cząsteczki lipidowe (Rysunek 4), zwane ogólnie N-acyletanolaminami (NAE), takie jak 2-arachidonoyloglicerol (2-AG), N-oleoyletanolamina (OEA), 2-arachidonylogliceryloeter (noladin, 2-AGE), wirodamina, N-arachidonoyletyloamina (NADA) i N-palmitoyletanolamina (PEA). AEA i 2-AG są najbardziej zbadanymi endokannabinoidami; jednak badania nad endokannabinoidami zostały kontynuowane, a odkryto dodatkowe receptory, wraz z ich mediatorami lipidowymi i ścieżkami sygnalizacyjnymi [81,83,84,85,86,87,88,89,90,91,92,93].
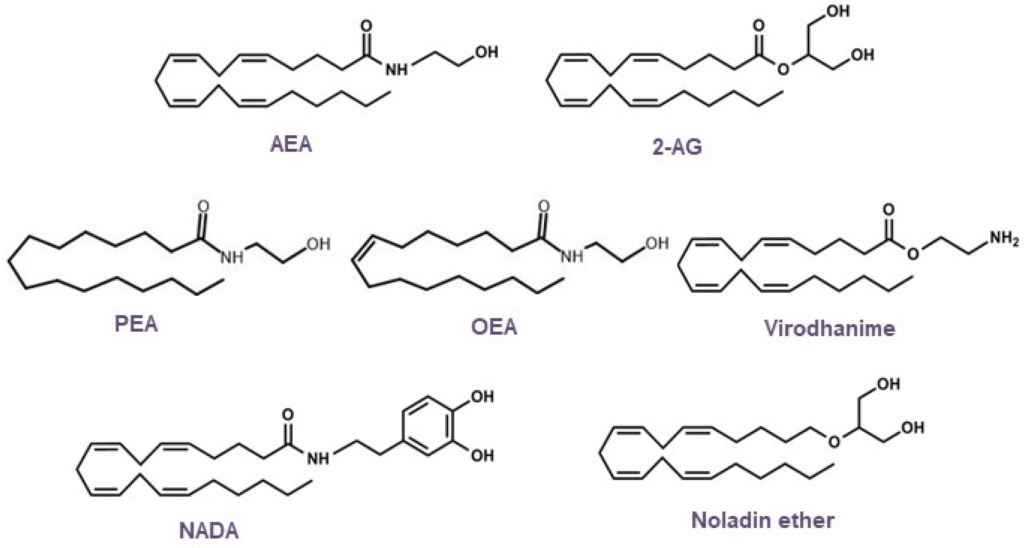
Rysunek 4. Struktury chemiczne głównych endokannabinoidów.
Endokannabinoidy, w przeciwieństwie do klasycznych neuroprzekaźników, są uważane za nietypowe przekaźniki ze względu na modulację informacji z zakończeń postsynaptycznych do zakończeń presynaptycznych, co jest znane jako mechanizm sygnalizacji zwrotnej. Endogenne ligandy są syntetyzowane na żądanie lub w wyniku aktywności zależnej od rozkładu błony fosfolipidowej i są natychmiast uwalniane po ich biosyntezie, aby działać jako czynniki pro-homeostatyczne poprzez oddziaływanie z określonymi receptorami [77,94,95].
Synteza i degradacja endogennych ligandów receptora kannabinoidowego obejmują różne reakcje enzymatyczne. Biosynteza AEA zachodzi poprzez jej uwalnianie z fosfolipidów błonowych i może przebiegać poprzez zależną od Ca2+ N-acylotransferazę (NAT) lub niezależną od Ca2+ ścieżkę N-acylotransferazę (iNAT). W wyniku tego N-arachidonoilo-fosfatydyloetanolaminy (NArPE) są tworzone, a przez działanie N-acylofosfatydyloetanolamino-specyficznej fosfolipazy D (NAPE-PLD), NArPE jest przekształcane w N-arachidonoiloetanolaminę (AEA) [55,96,97].
Inny endogenny ligand, 2-AG, jest tworzony za pomocą dwuetapowego mechanizmu. Początkowo 1,2-diacyloglicerol (DAG) jest syntetyzowany po rozkładzie fosfolipidu błonowego przez enzym fosfolipazy C (PLC). Następnie DAG jest estryfikowany przez enzym diacyloglicerolowa lipaza (DAGL), tworząc 2-AG [98,99].
Endogenne kannabinoidy stają się nieaktywne poprzez komórkowy mechanizm ponownego wychwytu za pomocą transporterów błonowych (EMT), a następnie ulegają intrakomórkowej degradacji pod wpływem enzymów hydrolitycznych. Anandamid głównie jest metabolizowany przez enzym hydrolazy amidu kwasu tłuszczowego (FAAH), a 2-AG jest substratem lipazy monoacyloglicerolowej (MAGL), która wytwarza kwas arachidonowy (AA) i glicerol [100,101] (Rysunek 5).
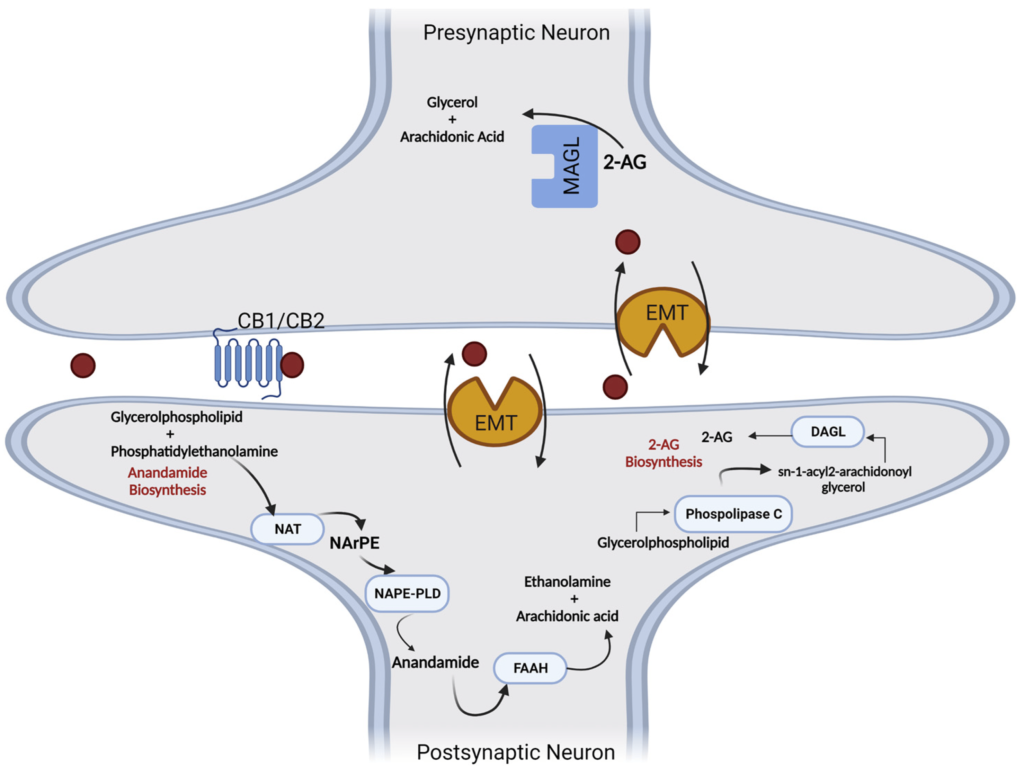
Rysunek 5. Szlaki metaboliczne zaangażowane w syntezę i degradację anandamidu (5) oraz 2-arachidonyloglicerolu (6). AA—kwas arachidonowy; 2-AG—2-arachidonyloglicerol; DAGL—lipaza diacyloglicerolowa; EMT—transportery błonowe; FAAH—hydrolaza amidu kwasu tłuszczowego; MAGL—lipaza monoacyloglicerolowa; NAPE-PLD—fosfolipaza D N-arachidonylofosfatydyloetanolaminy; NArPE—N-acylofosfatydyloetanolamina; NAT—N-acylotransferaza; PLC—fosfolipaza C.
Ponadto, AEA i 2-AG mogą być podatne na mechanizmy utleniania katalizowane przez cyklooksygenazy (COX), lipooksygenazy (LOX) i enzymy zaangażowane w utlenianie kwasu arachidonowego (AA), który ulega biotransformacji do prostaglandyn (PG), eikozanoidów oraz hydroksy-peroksy-anandamidu, między innymi związków pochodzących z tej reakcji metabolicznej [55,77].
Teoria niedoboru endokannabinoidów opiera się na koncepcji, że wiele zaburzeń mózgu jest związanych z niedoborem neuroprzekaźników, takich jak acetylocholina w chorobie Alzheimera (AD), dopamina w zespołach parkinsonowskich, a także serotonina i noradrenalina w depresji, podobny niedobór w poziomie endokannabinoidów może się manifestować w pewnych zaburzeniach, które wykazują przewidywalne cechy kliniczne jako skutki tego niedoboru [102,103,104].
W 2004 roku profesor dr Ethan Russo i jego współpracownicy zaproponowali zespół klinicznego niedoboru endokannabinoidów (CDS), sugerując, że zubożenie endokannabinoidów (hipofunkcjonalny eCB) może powodować wiele chorób, takich jak migrena, bardzo złożona choroba, która wiąże się z sygnalizacją między różnymi obszarami mózgu a różnymi neurochemicznymi przekaźnikami. Dokładna przyczyna migreny nie jest w pełni zrozumiała, chociaż predyspozycje genetyczne uważa się za główny czynnik przyczyniający się do jej powstawania i modyfikacji [102,104]. Możliwy związek między migreną a układem endokannabinoidowym został podkreślony przez kilka badań [105,106].
Fibromialgia również jest związana z niedoborami w układzie endokannabinoidowym i charakteryzuje się ostrym i przewlekłym rozległym bólem mięśniowo-szkieletowym w całym ciele. Ten ból często towarzyszy innym dolegliwościom, takim jak bezsenność, migrena, wahania nastroju, problemy z pamięcią, zespół jelita drażliwego (IBS) i przewlekłe zmęczenie. Charakterystyczne bolesne guzki, znane jako punkty spustowe, są zauważalne, zwłaszcza w ramionach i szyi. Podobnie jak w migrenie, fibromialgia wiąże się z hiperalgezją, czyli obniżonym progiem bólu związanym z hipofunkcją endokannabinoidów w rdzeniu kręgowym. Według Russo i innych, zatwierdzone leki na fibromialgię, duloksetyna, milnacipran (inhibitory serotoniny i adrenergii, odpowiednio) i pregabalina (przeciwpadaczkowe stosowane w leczeniu bólu neuropatycznego), wykazały niewielką skuteczność w porównaniu z kannabidoidami [106,107,108].
Zespół jelita drażliwego (IBS), znany również jako jelito kurczliwe, to zaburzenie czynnościowe charakteryzujące się bólem, skurczami, dyskomfortem i zmienionym ruchem jelit, głównie biegunką. Ruch, wydzielanie i stan zapalny w przewodzie pokarmowym są modulowane przez układ endokannabinoidowy, co uzasadnia stosowanie kannabinoidów w leczeniu IBS [109]. Badania wykazały, że zwiększone włókna czuciowe wyrażające receptory TRPV1 mogą przyczyniać się do nadwrażliwości trzewnej i bólu w IBS, co stanowi nowy cel terapeutyczny. Kannabidiol może być stosowany w interwencjach terapeutycznych ze względu na jego wpływ na receptory VR1 oraz zwiększanie sygnalizacji anandamidu. Jego analogi okazały się skutecznymi inhibitorami pobierania anandamidu przez komórki [110,111,112,113,114,115].
Zaburzenia neurodegeneracyjne mogą prowadzić do rozwoju choroby Parkinsona (PD) i AD. Zazwyczaj charakteryzują się one upośledzeniem funkcji poznawczych i innymi defektami neurologicznymi. Obecnie układ endokannabinoidowy jest badany jako cel terapeutyczny w PD i AD ze względu na nadmierne wyrażanie receptorów układu endokannabinoidowego, które wywierają neuroprotekcję przeciwko PD i zmniejszają neurozapalenie w AD. Stwierdzono zwiększone poziomy AEA w płynie mózgowo-rdzeniowym u nieleczonych pacjentów z PD, co sugeruje możliwy mechanizm kompensacyjny. Deficyty poznawcze u pacjentów z AD korelują z zaburzeniami wrażliwych obszarów mózgu, głównie w korze przedczołowej i hipokampie, które są bogate w CB1R. Δ9-THC i CBD wykazały neuroprotekcję w modelach zwierzęcych PD i AD; jednakże wywołały one toksyczne efekty u pacjentów, gdy były podawane bezpośrednio. Konieczne są badania w celu określenia skuteczności terapeutycznej ukierunkowanego na układ endokannabinoidowy leczenia chorób neurodegeneracyjnych [101,116,117,118].
W niektórych przypadkach układ endokannabinoidowy może być nadaktywny, co sprzyja zaburzeniom poznawczym obserwowanym w zespole łamliwego chromosomu X (FXS), zespole Downa i zespole Williamsa–Beurena (WBS). Oprócz przyczyn genetycznych tych zespołów wierzy się, że układ endokannabinoidowy jest nadaktywowany. W modelu zwierzęcym FXS, myszy z wyłączonym białkiem łamliwego chromosomu X (Fmr1) odtwarzają główne cechy choroby. Blokowanie CB1R i CB2R u samców myszy z wyłączonym Fmr1 normalizowało upośledzenie poznawcze i zachowanie przeciwlękowe, odpowiednio [119]. W preklinicznym modelu zespołu Downa segmentalnie trizomiczne myszy modelowe Ts65Dn wykazały, że ekspresja CB1R została wzmocniona, a jej funkcja zwiększona w synaptycznych zakończeniach w hipokampie. Redukcja ekspresji i blokada CB1R naprawiły deficyty pamięci u samców myszy Ts65Dn [120]. Aby ocenić model imitujący WBS, użyto myszy z tym samym usunięciem genetycznym, jak u pacjentów z WBS. Samce myszy wykazywały hiperaktywne zachowania społeczne, deficyty pamięci, powiększone serca i różnice w funkcji CB1R. Te myszy mutacyjne otrzymały JZL184, inhibitor MAGL, co poprawiło ich objawy społeczne i pamięciowe oraz funkcję serca [121]. Te badania wskazują, że modulacja nadaktywności układu endokannabinoidowego jest obiecującym podejściem terapeutycznym w leczeniu deficytów poznawczych związanych z zespołami genetycznymi.
- Molekuły Modulujące Układ Endokannabinoidowy
Konopie, będące roślinnym lekarstwem, są złożoną mieszaniną kilku związków, w tym fenoli kannabinoidowe, fenole niekannabinoidowe (proste fenole, spiro-indany, dihydrofenantreny i dihydrostilbeny), flawonoidy, terpenoidy, alkohole, aldehydy, n-alkany, estry woskowe, steroidy i alkaloidy. W 1899 roku Wood wyizolował kannabinol (CBN), pierwszy związek oczyszczony z tej rośliny. Obecnie wyizolowano i zgłoszono ponad 500 różnych substancji pochodzących z roślin konopi należących do różnych klas, spośród których klasa związków kannabinoidowych jest najbardziej reprezentatywna, ponieważ ma ponad 120 zidentyfikowanych związków, takich jak delta-ośmiotetrahydrokannabinol (Δ8-THC) i delta-dziewięciotetrahydrokannabinol (Δ9-THC), CBD i CBN (Figura 6). Zidentyfikowano różne klasy metabolitów wtórnych z różnych części rośliny, z szerokim zakresem zastosowań (nutraceutyki, kosmetyki, aromaterapia i farmakoterapia), korzystnych dla ludzi. Jednak w przeszłości badania skupiały się na dwóch najbardziej obfitych fitokannabinoidach, THC i CBD, co skutkowało większą wiedzą na temat ich działań farmakologicznych i wzrastającym zainteresowaniem licznych możliwości działań leczniczych tej rośliny [109,122,123,124,125,126,127,128]. CBD zyskuje na znaczeniu w badaniach farmakologicznych od lat 70. XX wieku. Epidiolex®, oczyszczony doustny lek zawierający CBD, jest obecnie zatwierdzony przez Agencję Żywności i Leków (FDA) w Stanach Zjednoczonych do leczenia trudnych do leczenia napadów padaczkowych rozpoczynających się w dzieciństwie [129,130].
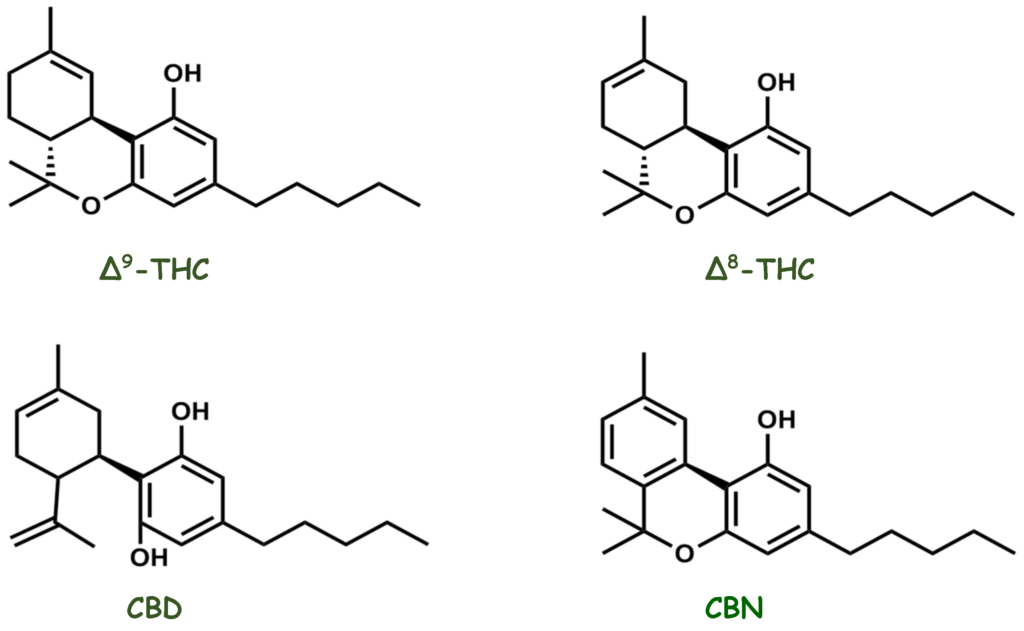
Rysunek 6. Struktury chemiczne głównych farmakologicznie aktywnych związków kannabinoidowych wyizolowanych z Cannabis sativa.
Jednakże biochemiczne podstawy działania farmakologicznego kannabinoidów pozostawały tajemnicą przez wiele lat. Wysoce lipofiliczna struktura molekularna kannabinoidów sugeruje, że wywierają one swoje działanie poprzez przenikanie błon komórkowych i oddziaływanie w ośrodkowym układzie nerwowym. Obecnie dostępne są istotne informacje na temat właściwości fizykochemicznych kannabinoidów. Nowoczesne selektywne ligandy dla receptorów kannabinoidowych mogą zawierać określone grupy substytuentów, które zwiększają kinetykę wiązania i zmniejszają skutki uboczne.
5. System endokannabinoidowy staje się obiecującym celem farmakoterapii przewlekłego bólu i zaburzeń nastroju.
Ból jest opisywany jako nieprzyjemne doświadczenie sensoryczne i emocjonalne związane z rzeczywistym lub potencjalnym uszkodzeniem tkanek lub w terminach takiego uszkodzenia. Kiedy ból utrzymuje się lub nawraca przez dłużej niż trzy miesiące, definiuje się go jako ból przewlekły, co ma znaczny wpływ na społeczeństwo. Szacuje się, że około 20% światowej populacji cierpi na ból przewlekły. Ważnym elementem jest również obserwacja depresji i lęku u takich pacjentów. Terapia bólu obejmuje zarówno leczenie farmakologiczne, jak i niefarmakologiczne. Do leczenia przewlekłego bólu często zaleca się leki przeciwdepresyjne, przeciwpadaczkowe oraz leki oddziałujące na układ nerwowy centralny. Substancje terapeutyczne uważane są za leki adiuwantowe, które pierwotnie nie zostały opracowane jako leki przeciwbólowe, ale wykazują właściwości przeciwbólowe i są lekami pierwszego rzutu w leczeniu bólu neuropatycznego i problemów psychiatrycznych. Niemniej jednak niektórzy pacjenci nie odczuwają ulgi w bólu i szukają innych terapii. Użycie ekstraktów z rośliny konopi (Cannabis sativa) do wywoływania różnych efektów leczniczych opisano już w trzecim tysiącleciu p.n.e. w chińskich tekstach. Ostatnio zainteresowanie właściwościami leczniczymi Cannabis sativa odrodziło się wraz z pojawieniem się systemu endokannabinoidowego (eCB), oferującego nie tylko nowe spojrzenie na mechanizmy działania terapeutycznego molekuł podobnych do kannabinoidów i fitokannabinoidów, ale także nowe molekularne cele dla farmakoterapii bólu.
CB1R może być aktywowany przez THC, co powoduje analgezję i wystąpienie działań niepożądanych (np. ból głowy, drętwienie, kaszel, uczucie pieczenia, zawroty głowy, uczucie odurzenia, senność, suchość w ustach i oczach). Wiele z tych zjawisk psychoaktywnych zależy od stężeń THC i może stanowić istotne wady jego stosowania w terapii farmakologicznej. Poprzednie badanie wykazało, że aktywacja CB1R powoduje upośledzenie pamięci. Ponadto THC i inne kannabinoidy aktywują receptory serotoniny 2A (5-HT2AR), wpływając na upośledzenie pamięci, działanie przeciwlękowe i interakcję społeczną. Badania wykazały, że CB1R i 5-HT2AR tworzą heteromery, które są wyrażane i funkcjonalnie aktywne w konkretnych obszarach mózgu zaangażowanych w upośledzenie pamięci, takich jak hipokamp i kora przedczołowa. Jednakże upośledzenie pamięci i lęk zostały zniesione u myszy typu dzikiego za pomocą antagonisty 5-HT2AR lub selektywnego zakłócenia heteromerów CB1R/5-HT2AR poprzez infuzję syntetycznych interferencyjnych peptydów, nie tracąc jednocześnie efektu przeciwbólowego. Trwające badania nad stosowaniem Cannabis pokazują, że sprzyja ono złagodzeniu bólu i rozłącza upośledzenie pamięci, co zmniejsza wady stosowania kannabinoidów jako substancji terapeutycznych. CB2R odgrywa istotną rolę w modulacji analgezji poprzez dwie ścieżki. Pierwszy mechanizm zachodzi w obwodowym układzie immunologicznym, gdzie receptory CB2 mediują analgezję, modyfikując profil cytokin i zapobiegając niepożądanym efektom w ośrodkowym układzie nerwowym. Po drugie receptory CB2 obecne w komórkach glejowych i neuronach przyczyniają się do złagodzenia bólu. Dodatkowo badania wykazały, że selektywne agonisty CB2 promują antynocicepcję. Ponadto badania nad ludźmi wykazały, że naturalne i syntetyczne kannabinoidy, takie jak dronabinol i nabilon, mają zastosowanie w łagodzeniu przewlekłego bólu, a zaobserwowano terapeutyczną skuteczność w leczeniu bólu i poprawie jakości życia pacjentów. System eCB jest rozpowszechniony w obrębie rdzenia kręgowego i nadrdzenia, dzięki czemu może skutecznie regulować przetwarzanie nocicepcyjne.
Lęk i zaburzenia paniki, główne stany depresyjne oraz choroba afektywna dwubiegunowa (choroba maniakalno-depresyjna) to poważne i potencjalnie zagrażające życiu komplikacje nastroju. Ponad 20% dorosłej populacji doświadcza zaburzeń nastroju w pewnym okresie życia. W ciągu ostatnich dziesięcioleci dokonano wielu postępów w leczeniu zaburzeń nastroju. Około 30% populacji nie reaguje na obecne terapie, dlatego trwa poszukiwanie nowych podejść farmakologicznych. Efekty psychoaktywne Cannabis obejmują działanie uspokajające, przeciwlękowe, nasenne i euforyczne. Niektóre z tych czynników pozytywnie wpływają na nastrój. Jednak u niektórych osób mogą pojawić się objawy takie jak paranoja, drażliwość, dysforia, depresja, depersonalizacja i brak motywacji, jako skutki uboczne. Reakcje te zależą od aktywności endokannabinoidowej pacjenta, dawki używanej (normalnie działającej stymulująco przy niskiej dawce i hamująco przy wysokiej dawce), proporcji fitokannabinoidów i składu terpenoidowego. Narasta dowody na rolę systemu endokannabinoidowego w regulacji nastroju. Badania kliniczne wykazały zaburzenia sygnalizacji endokannabinoidowej u pacjentów psychiatrycznych. Polimorfizmy genetyczne w CB1R i CB2R są związane z depresją, chorobą afektywną dwubiegunową oraz opornością na terapię, co zaobserwowano u pacjentów z depresją posiadających polimorfizm jednonukleotydowy w CB1R. Ponadto system endokannabinoidowy może modyfikować funkcje wszystkich osi podwzgórzowo-przysadkowo-nadnerczowej za pośrednictwem CB1R, a przewlekły stres wydaje się obniżać zdolność systemu endokannabinoidowego do hamowania stresu, co może prowadzić do psychopatologii, w tym depresji i lęku. W tym kontekście ważne jest przypomnienie losów leku rimonabantu, pierwszego blokera receptorów kannabinoidowych zatwierdzonego do leczenia zespołu metabolicznego, otyłości i palenia tytoniu. Jednak ze względu na ważne działania niepożądane, które ujawniły się u pacjentów po długotrwałym stosowaniu rimonabantu, firma Sanofi-Aventis wycofała go z rynku. Lek ten głównie wywiera korzystne efekty, blokując receptory CB1 na obwodzie. Jednak ze względu na swoją lipofilową naturę rimonabant może przenikać przez barierę krew-mózg i dostawać się do ośrodkowego układu nerwowego, co związane jest z rozwojem depresji, myśli samobójczych i zaburzeń lękowych. Właściwości podnoszące nastrój kannabinoidów są od dawna znane i uważane za nieszkodliwe. Niektóre składniki Cannabis lub ich mieszaniny mogą wykazywać działanie przeciwdepresyjne i/lub przeciwlękowe. Wielu pacjentów niereagujących na standardowe leki przeciwdepresyjne może skorzystać z leczenia medycznego Cannabis. Kannabinoidy mogą mieć potencjał terapeutyczny zarówno w depresji, jak i chorobie afektywnej dwubiegunowej. Dotyczy to pacjentów z zaburzeniami nastroju, którzy dodają Cannabis do istniejącego leczenia, ponieważ taka kombinacja może poprawić skuteczność leku i/lub zmniejszyć jego skutki uboczne. Cannabis może działać stabilizująco na nastrój w chorobie afektywnej dwubiegunowej i pełnić funkcję adiuwantową w leczeniu litu. Pacjenci z zaburzeniem nastroju mogą nie być obiektywni w ocenie swojego stanu i nie mogą decydować samodzielnie o modyfikacji leczenia. Dlatego ważna jest profesjonalna opieka i kontrola.
6. Harmonizacja układu endokannabinoidowego poprzez praktyki zdrowia integracyjnego i uzupełniającego (ICHP).
Integracyjne i uzupełniające praktyki zdrowia (ICHP), znane również jako „komplementarne i alternatywne metody leczenia (CAM)”, obejmują różne systemy medyczne i zdrowotne, praktyki i produkty, które obecnie nie są częścią konwencjonalnych terapii. CAM jest podzielony na trzy główne grupy: „produkty naturalne” (suplementy diety i ziołowe), „medycyna umysłowo-cielesna” (medytacja, joga i akupunktura) oraz „praktyki oparte na ciele” (masaż i manipulacja kręgosłupa) [195,196].
Badanie na gryzoniach przeprowadzone przez Chena i in. pokazało, że elektroakupunktura promuje aktywność przeciwnocyceptywną u zwierząt i zwiększa poziomy AEA w tkance skórnej. Stwierdzono również, że efekty przeciwnocyceptywne zostały osłabione przy użyciu AM630, antagonisty CB2R, ale nie przy użyciu antagonisty CB1R AM25 [197]. Ponadto AEA zwiększyło ekspresję CB2R w skórze [198,199]. Aktywacja CB2R w skórze prawdopodobnie stymuluje uwalnianie β-endorfiny, która następnie działa na obwodowe receptory μ-opioidowe, hamując przeciwnocycepcję [51]. Ponadto elektroakupunktura udzielała ochrony neurologicznej przed niedokrwieniem mózgu poprzez stymulację mobilizacji endokannabinoidów w mózgu i aktywację CB1R [200,201].
Sadhasivam i in. sugerują, że endokannabinoidy mogą pełnić rolę biomarkerów po sesji medytacyjnej. Wyniki sugerują, że główne endokannabinoidy, w tym AEA, 2-AG, 1-AG, DEA, OLA oraz czynnik neurotropowy pochodzenia mózgowego (BDNF), zwiększały się po medytacji u ponad 70% pacjentów, co wskazuje na istotną rolę tych biomarkerów w mechanizmie działania medytacji [202]. Badania sugerują istnienie korelacji między akupunkturą a układem endokannabinoidowym poprzez dzielenie się efektami biologicznymi, takimi jak analgezja, neuroprotekcja i regulacja układu sercowo-naczyniowego. Lepsze zrozumienie tych wewnętrznych powiązań między akupunkturą a CES może pozwolić na opracowanie nowych technik łączących akupunkturę z substancjami terapeutycznymi ukierunkowanymi na sygnał lizy endokannabinoidów [203,204,205,206].
Inne badanie wykazało, że masaż i osteopatyczna manipulacja u zdrowych uczestników zwiększyły poziomy AEA we krwi o 168% w porównaniu z poziomami przed leczeniem; nie stwierdzono zmian w poziomach 2-AG. U uczestników poddanych manipulacji pozorowanej (kontrola) nie zaobserwowano zmian [207]. Zintegrowane podejście, łączące akupunkturę, masaż, jogę, metody umysłowo-cielesne i medyczną konopię, może być skuteczne. Na przykład pacjent z przewlekłym bólem neuropatycznym wykazuje poprawę w obrazie klinicznym, gdy jest leczony w ten sposób [208]. W związku z tym konieczne jest zastosowanie złożonego, zindywidualizowanego podejścia, podkreślając prowadzenie pacjenta i zaangażowanie w metody integracyjne oraz lecznicze stosowanie konopi.
7. Perspektywy badawcze i trendy w układzie endokannabinoidowym.
Od początku badań naukowych nad kannabinoidami, ze szczególnym uwzględnieniem izolacji i identyfikacji fitokannabinoidów, takich jak THC, naukowcy nieustannie doskonalą wiedzę na temat farmakologii, biochemii i klinicznych efektów Cannabis. Od lat dobrze znane są efekty fizjologiczne jej spożycia, zwłaszcza stan euforii. Jednak to, co zachodzi wewnątrz naszych organizmów na poziomie molekularnym, zwłaszcza w mózgu, aby zmienić świadomość, wciąż pozostaje nieznane. W 1973 roku amerykańscy badacze zidentyfikowali receptory w mózgu związane z opioidami. Niektórzy naukowcy spodziewali się, że odkrycie receptorów dla marihuany nastąpi szybko. Jednakże nie było to takie łatwe ani szybkie, jakby chcieli. Badania przeprowadzone przez Allyn Howletta i Williama Devane’a wykazały, że receptory kannabinoidowe są obecne w mózgu bardziej niż jakiekolwiek inne receptory sprzężone z białkami G [206,209,210,211].
CB1R i CB2R, będące częścią układu endokannabinoidowego, odgrywają kluczową rolę w licznych warunkach fizjologicznych i chorobach ludzkich. Dlatego podejmowane są znaczne wysiłki w celu opracowania ligandów dla CB1R i CB2R, co skutkuje powstaniem setek fitokannabinoidów i syntetyków, które wykazały zróżnicowane powinowactwo do leczenia różnych chorób [17]. Jednak tylko kilka z tych ligandów jest używanych klinicznie. Obecnie dzięki krioelektronowej mikroskopii ujawniono bardziej szczegółowe informacje strukturalne receptorów kannabinoidowych, co przyspieszyło odkrywanie substancji opartych na strukturze [209]. Jednocześnie pojawiły się nowe kannabinoidy peptydopodobne pochodzenia zwierzęcego, które wykazują potencjalne efekty terapeutyczne in vivo na receptorach kannabinoidowych [212,213].
Z perspektywy produktów naturalnych oczekuje się, że nowe kannabinoidy zostaną odkryte i uznane za prototypy obiecujących leków pochodzących z różnych źródeł i gatunków naturalnych, takich jak jady zwierzęce, które stanowią prawdziwą farmakopeę toksyn modulujących różne cele, w tym kanały jonowe i receptory sprzężone z białkami G, takie jak CB1R i CB2R, z istotnym powinowactwem i selektywnością [214]. Dlatego sądzi się, że odkrywanie nowych kannabinoidów poprzez badanie bioróżnorodności gatunków zamieszkujących Ziemię to obszar, który jeszcze nie został zbadany.
8. Wnioski
W tej recenzji omówiono role receptorów kannabinoidowych i ich agonistów w wielu stanach chorobowych. Od czasu rozpoczęcia badań nad pochodnymi Cannabis i biologicznymi funkcjami izolowanych związków w doświadczalnych i ludzkich chorobach wykazują one obiecujące wyniki. Wydaje się, że selektywne ligandy określonych receptorów kannabinoidowych mogą wywoływać korzystne rezultaty w zależności od warunków klinicznych. Należy zachęcać do prowadzenia dalszych badań nad biologiczną funkcją każdej pochodnej Cannabis.
