Endokannabinoidy przez aktywację swoistych receptorów wpływają na regulację homeostazy energetycznej ustroju. Kontrolują m.in. pobór pokarmu, wydzielanie insuliny, metabolizm lipidów i glukozy, magazynowanie tłuszczów. Głównym substratem energetycznym mięśnia sercowego są długołańcuchowe kwasy tłuszczowe. Jednak serce ma ogromną elastyczność metaboliczną przejawiającą się zdolnością do utylizowania nie tylko kwasów tłuszczowych, ale także glukozy, mleczanów i ciał ketonowych. Endokannabinoidy mogą bezpośrednio oddziaływać na kardiomiocyty poprzez obecne na ich powierzchni receptory CB1 i CB2. Wydaje się, że bezpośrednia aktywacja receptorów CB1 sprzyja wzmożonej lipogenezie, stłuszczeniu osierdzia i zaburzeniom czynności bioelektrycznej serca. Natomiast pobudzone receptory CB2 wykazują właściwości kardioprotekcyjne, przyczyniając się do zachowania odpowiedniego stężenia ATP w kardiomiocytach. Ponadto, działanie endokannabinoidów zarówno na poziomie ośrodkowego układu nerwowego, jak i tkanek obwodowych, tj. wątroby, trzustki czy też tkanki tłuszczowej, pośrednio przekłada się na dostępność osoczową substratów energetycznych i wpływa na metabolizm mięśnia sercowego. Niewiele jest bezpośrednich dowodów opisujących skutki aktywacji układu endokannabinoidowego w warunkach fizjologicznych w układzie krążenia. W pracy opisano wpływ chorób metabolicznych, m.in. otyłości i cukrzycy, a także chorób układu krążenia – nadciśnienia, niedokrwienia i zawału na deregulację układu endokannabinoidowego z następczym wpływem na metabolizm kardiomiocytów.
Układ endokannabinoidowy
Układ endokannabinoidowy jest endogennym, kompleksowym systemem sygnałowym biorącym udział w licznych procesach fizjologicznych. Układ ten tworzą:
• receptory endokannabinoidowe (CB – cannabinoid receptor) z rodziny receptorów 7-transbłonowych,
• endokannabinoidy, czyli endogenne ligandy receptorów CB,
• enzymy zaangażowane w syntezę, wychwyt i degradację endokannabinoidów [23,43].
Dotychczas najwięcej informacji o układzie endokannabinoidowym pochodzi z badań nad ośrodkowym układem nerwowym [33].
Receptory endokannabinoidowe
Dotąd odkryto dwa główne rodzaje receptorów endokannabinoidowych – receptor typu I – CB1 oraz receptor typu II – CB2 [48,90]. Zarówno receptor CB1 jak i CB2 należą do grupy receptorów metabotropowych sprzężonych z biał- kiem G i wykazują homologię w 44% [48].
Receptor CB1 jest zbudowany z 472 aminokwasów i jest kodowany przez gen CNR1 [13,61]. Receptory CB1 są umiejscowione głównie na zakończeniach presynaptycznych neuronów ośrodkowego i obwodowego układu nerwowego. Ponadto w mózgu wykryto receptor CB1A, który jest białkowym produktem genu kodującego receptor CB1, powstałym w wyniku jego alternatywnego składania [48]. Należy podkreślić, że receptory CB1 poza ośrodkowym układem nerwowym wykazują ekspresję w licznych narządach obwodowych, tj. mięśniu sercowym, mięśniach szkieletowych, płucach, jądrach, nasieniowodach, macicy, pęcherzu moczowym, nabłonku jelita cienkiego i grubego, a także w tkance tłuszczowej [7,31,81]. Z dotychczas przeprowadzonych badań wynika, że aktywacja receptorów CB1 występujących w mięśniu sercowym wywołuje skutek inotropowy ujemny, natomiast aktywacja receptorów CB1 w obrębie naczyń wieńcowych powoduje ich wazodylatację [7,102]. Ponadto ekspresję receptorów CB1 wykryto w hodowlach komórek śródbłonka tętnic wień- cowych, a także w kardiomiocytach [73,88]. Natomiast w badaniach in vivo stwierdzono obecność receptorów CB1 na zakończeniach presynaptycznych włókien współ- czulnych unerwiających naczynia oporowe i serce oraz na zakończeniach postsynaptycznych włókien współczulnych w naczyniach krwionośnych [62,73,88,89,91]. W badaniach przeprowadzonych na szczurach wykazano, że aktywacja receptorów CB1 występujących na zakończeniach presynaptycznych włókien współczulnych naczyń oporowych i wieńcowych hamuje sekrecję noradrenaliny z tych zakończeń, co prowadzi do zmniejszenia neurogennej odpowiedzi presyjnej i tachykardii [62,91].
Receptor CB2 jest utworzony z 360 aminokwasów, a za jego ekspresję odpowiada gen CNR2 [13]. Ekspresję receptora CB2 wykazano głównie na komórkach i narzą- dach wchodzących w skład układu immunologicznego, a także w strukturach ośrodkowego układu nerwowego, w tym komórkach mikrogleju [99]. Stwierdzono również obecność receptorów CB2 w kardiomiocytach, kardiomioblastach, a także w komórkach śródbłonka tętnic wieńcowych i komórkach mięśni gładkich naczyń krwionośnych [73,86,87,94]. Uważa się, że receptory CB2 są zaangażowane głównie w regulację procesów odpowiedzi immunologicznej [82]. Wykazano, że aktywacja receptorów CB2 w komórkach śródbłonka naczyń wieńcowych zmniejsza wytwarzanie cytokin przeciwzapalnych, w tym czynnika martwicy guza α (TNF-α – tumor necrosis factor alfa) [86]. Tym samym, wpływa to na chemotaksję i adhezję komórek układu odpornościowego do zaktywowanego śródbłonka [86]. Natomiast aktywacja receptora CB2 w komórkach mięśni gładkich tętnic wieńcowych powoduje zahamowanie ich proliferacji [87].
Wyniki wielu prac z ostatnich lat wykazują istnienie jeszcze innych rodzajów receptorów regulujących homeostazę ustroju z udziałem układu endokannabinoidowego. W danych literaturowych dość często wspominana jest obecność tzw. hipotetycznego receptora śródbłonkowego [19,51,89]. Potwierdzeniem powyższego stwierdzenia wydaje się występowanie rozkurczu izolowanej tętnicy krezkowej i towarzyszący temu spadek ciśnienia krwi pod wpływem anandamidu zarówno u myszy transgenicznych CB1-/-/CB2-/-, jak i u myszy niemodyfikowanych genetycznie [51]. Ponadto zniszczenie śródbłonka naczyniowego i podanie rimonabantu (antagonisty receptorów CB1) w stężeniu wyższym niż jest to wymagane do zablokowania receptorów CB1 zniosło opisaną wyżej zarówno wazodylatację, jak i hipotensję [41,51].
Ligandy receptorów endokannabinoidowych
Endogenne ligandy receptorów endokannabinoidowych są pochodnymi kwasu arachidonowego, będącego metabolitem fosfolipidów błon komórek nerwowych [23]. Wykazano, że endokannabinoidy nie są magazynowane, a ich synteza odbywa się natychmiast po zadziałaniu bodźca w postaci potencjału czynnościowego, jest to tzw. „synteza na żądanie” [27]. Uwolnienie endokannabinoidów do przestrzeni synaptycznej następuje podczas depolaryzacji błony komórkowej elementu postsynaptycznego neuronu w wyniku następczego napływu jonów wapnia do wnętrza komórki [14]. Stwierdzono też, że endokannabinoidy należą do transmiterów wstecznych, tzn. są uwalniane z zakończenia postsynaptycznego, a wpływają na element presynaptyczny, gdzie są obecne ich receptory [4,28]. Mechanizm komunikacji między neuronami nazwano indukowanym depolaryzacją zmniejszaniem hamowania (DSI – depolarization-induced suppression of inhibition) lub indukowanym depolaryzacją zmniejszaniem pobudzania (DSE – depolarization-induced suppression of excitation). Zależy to od tego, czy zablokowane zostaje wydzielanie neuromediatorów hamujących, np. kwasu γ-aminomasłowego, czy też pobudzających, np. noradrenaliny, czy też serotoniny z elementu presynaptycznego neuronu [75].
Jak dotąd udało się zidentyfikować cztery związki wykazujące działanie agonistyczne w stosunku do receptorów endokannabinoidowych. Pierwszym z odkrytych endokannabinoidów był anandamid (AEA), który wyizolowano z mózgu świni [21]. Wykazuje większe powinowactwo do receptora CB1 (którego jest częściowym agonistą) ani- żeli CB2 [90]. Anandamid pobudza również receptory N- -metylo-D-asparaginowe (receptory NMDA) [48]. Innym z odkrytych agonistów był 2-arachidonyloglicerol (2-AG), który ma mniejsze powinowactwo do receptora CB1 w porównaniu z anandamidem, a jednocześnie jest pełnym agonistą tego receptora, co oznacza, że po związaniu z receptorem CB1 wywołuje większy efekt niż anandamid. Zarówno w badaniach in vivo, jak i in vitro, wykazano, że oba związki charakteryzują się małą stabilnością wynikająca z budowy chemicznej i szybko ulegają hydrolizie [90]. Innym ligandem w układzie endokannabinoidowym jest eter noladyny, mający podobnie jak 2-AG niskie powinowactwo do receptora CB1. Jednak eter noladyny ze względu na obecność wiązania eterowego ma większą stabilność w porównaniu z poprzednimi agonistami, co może wpływać na wydłużenie wywoływanego przez ten związek działania biologicznego [40]. Do grupy agonistów receptorów endokannabinoidowych zalicza się również endovanilloid (zwany też N-arachidonoyletanolaminą, dopaminą N-arachidonylową, NADA), będący agonistą zarówno receptora CB1, jak też receptora waniloidowego typu 1 (TRPV1) [25]. Istnieją także inne związki wykazujące aktywność wobec receptorów endokannabinoidowych, m.in. palmitoiloetanolamid (PEA), oleiloetanolamid (OEA), będące odpowiednio pochodnymi kwasu palmitynowego i kwasu oleinowego [8,54]. Palmitoiloetanolamid może aktywować receptor CB1, a także CB2 [8]. Natomiast oleiloetanolamid wykazuje niewielkie powinowactwo wobec receptora CB1, przy czym w ogóle nie wpływa na receptory CB2 [54,76].
Jedynym zbadanym endogennym ligandem, który wykazuje cechy antagonistyczne wobec receptorów endokannabinoidowych jest wirodhamina [83]. Synteza tego związku jest związana z estryfikacją kwasu arachidonowego przez etanolaminę. Należy podkreślić, że wirodhamina wykazuje właściwości antagonistyczne tylko w stosunku do receptora CB1, podczas gdy wobec receptora CB2 działa agonistycznie [83]. Poza aktywacją receptorów metabotropowych w komórkach docelowych, endokannabinoidy mają zdolność bezpośredniej aktywacji receptorów jonotropowych, m.in. receptorów TRPV1, serotoninowych 5HT3 oraz nikotynowych dla acetylocholiny z podjednostką α7 [79].
Enzymy i białka transportowe biorące udział w metabolizmie endokannabinoidów
Zgodnie z obecną wiedzą, endokannabinoidy po wydzieleniu do przestrzeni synaptycznej ulegają wychwytowi zwrotnemu. Jest to możliwe dzięki obecności białek transportujących endokannabinoidy, znajdujących się w błonie elementu postsynaptycznego. Najlepiej poznano białko swoiste dla anandamidu zaangażowane w jego wychwyt zwrotny i wewnątrzkomórkowy transport, które nazwano FAAH-podobnym transporterem anandamidu (FLAT – FAAH-like anandamide transporter) [34,64]. Wśród innych białek, które najprawdopodobniej mogą być związane z transportem wewnątrzkomórkowym endokannabinoidów wyróżnić należy: białko wiążące kwasy tłuszczowe 5 i 7 (FABP 5 and 7 – fatty acid binding protein 5 and 7), białko szoku cieplnego 70 (HSP 70 – heat shock protein 70) oraz albuminy [5,52,78]. Wychwycone przez białka transportowe endokannabinoidy pod wpływem enzymu hydrolazy amidowej kwasów tłuszczowych (FAAH) oraz lipazy monoacyloglicerolowej (MGL) we wnętrzu elementu postsynaptycznego ulegają następnie hydrolizie [45]. Stwierdzono, że w stosunku do AEA największą swoistość wykazuje FAAH, natomiast wobec 2-AG zarówno FAAH, jak i MGL są tak samo swoiste [12,45].
Po raz pierwszy MGL jako hydrolazę serynową inaktywującą 2-AG opisano na podstawie doświadczenia przeprowadzonego na mózgu szczura [29]. Powstający w wyniku hydrolizy kwas arachidonowy, może się stać substratem do syntezy m.in. prostaglandyn, co wskazuje, iż prawdopodobnie inhibicja MGL niesie za sobą ogromny potencjał przeciwbólowy i przeciwzapalny [75]. W badaniach przeprowadzonych na szczurach, którym indukowano ból stwierdzono, że zablokowanie rozkładu 2-AG przez inhibitory MGL wywołuje efekt antynocyceptywny zależny od aktywacji receptorów CB1 bądź CB2 [39]. Jednocześnie w innych badaniach wykonanych na myszach, z wyindukowanym zapaleniem jelit, dowiedziono, że po zastosowaniu inhibitorów MGL następuje zmniejszenie ekspresji cytokin prozapalnych, tj. IL-1β i TNF-α [1]. Należy podkre- ślić, że obecność enzymu MGL wykazano również w sercu szczura [53]. Mimo braku badań, nie jest wykluczone, że zastosowanie inhibitorów MGL może mieć znaczenie w zmniejszeniu syntezy prostaglandyn i ograniczeniu rozwoju stanu zapalnego podczas epizodów niedokrwienia mięśnia sercowego.
Znacznie więcej doniesień dotyczy roli FAAH w regulacji układu endokannabinoidowego [16,74,80]. Wyróżnia się dwie izoformy enzymu FAAH – FAAH-1 oraz FAAH-2. Enzym FAAH-1 wykazuje ekspresję u wszystkich ssaków, podczas gdy FAAH-2, nie przejawia ekspresji u wszystkich gatunków, m.in. nie występuje u szczurów [25]. Wewnątrzkomórkowa hydrolityczna aktywność tych enzymów pozwala utrzymać dokomórkowy gradient stężeń endokannabinoidów na odpowiednim poziomie [5]. Najprawdopodobniej enzym FAAH wpływa na możliwości modulowania sygnału przekazywanego przez układ endokannabinoidowy, umożliwiając zastosowanie FAAH w terapii bólu, nudności, a także przeciwdziałaniu uszkodzeniom serca powstałym np. na wskutek przyjmowania leków kardiotoksycznych (m.in. doksorubicyny) [74]. Wykazano, że u myszy pozbawionych genu kodującego FAAH (FAAH-/-) wzrosta poziom anandamidu w miokardium w porównaniu do myszy szczepu dzikiego (FAAH+/+) [80]. Ponadto myszy FAAH-/- w porównaniu do myszy nieznokautowanych wykazują większą wrażliwość na dzia- łanie depresyjne egzogennego anandamidu w układzie sercowo-naczyniowym. Potwierdzeniem obserwacji jest wydłużenie czasu hipotensji zależnej od aktywacji receptorów CB1 oraz zmniejszenie kurczliwości mięśnia sercowego w trójfazowej odpowiedzi hemodynamicznej na dożylne podanie anandamidu u myszy FAAH-/- [80]. Prawdopodobnie jest to wynikiem braku szybkiej inaktywacji egzogennie podanego anandamidu przez różne tkanki [16,80], w tym miokardium [80]. Jednocześnie myszy FAAH-/- zachowują prawidłową czynność serca, wartość ciśnienia krwi oraz wrażliwość baroreceptorów mimo wzrostu poziomu endogennego anandamidu w mięśniu sercowym tych zwierząt [80].
Wiedza na temat enzymatycznej regulacji układu endokannabinoidowego ulega stałemu pogłębianiu. Istnieją doniesienia na temat licznych enzymów, m.in. lipooksygenazy, cytochromu P450, cyklooksygenazy 2, które mogą przekształcać endokannabinoidy do bioaktywnych produktów (pochodnych eikozanoidów, np. etanolamidu prostaglandyny E2), których fizjologiczna rola pozostaje jak dotąd niewyjaśniona [17,103]. Zmiany stężeń zarówno transporterów jak i enzymów mogą zaburzać metabolizm i aktywność endokannabinoidów wytwarzanych w tkankach [45].
Mechanizm aktywacji postreceptorowej w układzie endokannabinoidowym
Pobudzenie receptorów CB1 i CB2 przez swoiste ligandy powoduje aktywację białka Gi/o [48], co w obu przypadkach wywołuje spadek aktywności cyklazy adenylowej i wewnątrzkomórkowego stężenia cAMP [99]. W przypadku receptorów CB1 sugeruje się, że aktywacja białka Gi/o pobudza kaskady kinaz aktywowanych mitogenami (MAPK), odbywającej się przez aktywację kinazy 3-fosfatyloinozytolu [46,48]. Receptory CB1 poprzez aktywację białka Gi/o wpływają na regulację czynności błonowych kanałów jonowych wapnia (kanały typu N, L, P/Q) i potasu (kanałyypu A i Ir). W wyniku aktywacji receptorów CB1 obecne w błonie komórkowej komórek docelowych kanały wapniowe ulegają zamknięciu, przy czym nastę- puje aktywacja i otwarcie kanałów potasowych [48]. Aktualny stan wiedzy wskazuje, że w przypadku aktywacji receptorów CB2 w szlaku transmisji sygnału bierze udział kinaza białkowa C [46] i jak dotąd nie stwierdzono, aby aktywacja receptorów CB2 wpływała na działanie kana- łów jonowych [98].
Ponadto obecne w błonie komórkowej receptory CB1 są związane ze specjalnymi mikrodomenami błonowymi, zwanymi „tratwami lipidowymi” (LR – lipid rafts), które zawierają duże stężenia cholesterolu i glikosfingolipidów. Tratwy lipidowe modulują zdolność wiązania ligandów z receptorami CB1 i wpływają na wewnątrzkomórkowe CB1-zależne szlaki sygnalizacyjne [3]. W badaniach na hodowlach C6 komórek glejaka stwierdzono, iż błonowa zawartość cholesterolu wpływa na integralność tratw lipidowych z błoną komórkową i moduluje tym samym interakcję endokannabinoidów z receptorami [3]. W tych badaniach, w wyniku usuwania cholesterolu z błony komórkowej przez metylo-β-cyklodekstrynę, zauważono zależne od dawki metylo-β-cyklodekstryny zwiększenie wiązania receptorów CB1 ze swoistymi ligandami, m.in. [3H]CP55.940 [3]. Ponadto nastąpił też wzrost przekazywania sygnału zależnego od białek Gi/o związany ze zwiększeniem aktywacji szlaków sygnałowych cyklazy adenylowej i MAPK [3].
Specyfika metabolizmu mięśnia sercowego
W warunkach fizjologicznych w mięśniu sercowym zachodzi metabolizm tlenowy, którego zadaniem jest ciągła resynteza ATP. W celu pozyskania energii są wykorzystywane w 60-70% długołańcuchowe kwasy tłuszczowe (LCFA), w 20-30%, glukoza, a także mleczany i ciała ketonowe [36,96]. Wykazano, że wybór substratu energetycznego zależy od jego dostępności we krwi krążącej, a także od zmian zapotrzebowania energetycznego mię- śnia sercowego [96].
Ze względu na to, iż LCFA stanowią jeden z podstawowych substratów energetycznych mięśnia sercowego, przeprowadzono wiele badań, które dostarczyły istotnych informacji o ich dokomórkowym transporcie. Wykazano, że LCFA dostają się do wnętrza kardiomiocytów na zasadzie biernej dyfuzji (20%) [6] lub z udziałem swoistych białek transportujących kwasy tłuszczowe w procesie transportu wspomaganego (80%) [100]. Do białek tych w mięśniu sercowym zalicza się: FAT/CD36 – translokazę kwasów tłuszczowych, FABPpm – błonowe białko wiążące kwasy tłuszczowe oraz FATP-1, FATP-4 i FATP-6 – białka transportujące kwasy tłuszczowe typu 1, 4 i 6 [30,36]. Ustalono, że białka te znajdują się nie tylko w błonie kardiomiocytów, ale również tworzą pulę zgromadzoną w pęcherzykach wewnątrzkomórkowych mającą zdolność translokacji na powierzchnię błony komórkowej [96]. Translokacja białek transportujących LCFA do błony komórkowej, m.in. pod wpływem czynności skurczowej kardiomiocytów [92], czy też w wyniku stymulacji hormonalnej, np. insuliną [59] zwiększa napływ LCFA do wnętrza kardiomiocytów [59]. W ten sposób możliwe jest dostosowanie podaży substratów energetycznych do aktualnego zapotrzebowania miokardium na energię [6,59]. LCFA po wejściu do wnętrza kardiomiocytów są wiązane przez cytoplazmatyczne białko wiążące kwasy tłuszczowe typu sercowego (H-FABPc) [6]. W takiej postaci LCFA mogą podlegać aktywacji enzymatycznej przez syntetazę acylo-CoA (FACS) po związaniu z koenzymem A (CoA). Aktywny kompleks enzym-substrat łączy się z białkami wiążącymi acylo-CoA (ACBP), co powoduje przemieszczenie LCFA-CoA na dalszy tor przemian w kierunku β-oksydacji lub estryfikacji do określonych frakcji lipidowych [96]. W pierwszym przypadku LCFA związane z CoA dostają się do wnętrza mitochondrium z udziałem enzymu umiejscowionego na zewnętrznej błonie mitochondrialnej – palmitoilotransferazie karnitynowej I (CPT I) oraz karnitynie [58]. Dochodzi do wytworzenia acylokarnityny i uwolnienia CoA. Transport między błoną zewnętrzną a wewnętrzną mitochondrium odbywa się z udziałem kolejnego enzymu, którym jest acylotranslokaza karnitynowa (CAT). Aby doszło do utleniania kwasów tłuszczowych reszta acylowa musi ulec odłączeniu od karnityny i połączyć się z CoA znajdującym się wewnątrz mitochondrium. Na tym etapie katalizowana jest palmitoilotransferaza karnitynowa II. Gdy zostaje odtworzony acylo-CoA, w macierzy mitochondrialnej następuje utlenianie kwasów tłuszczowych, mające na celu wytworzenie energii w postaci ATP, odbywające się dwuetapowo. Pierwszym etapem jest β-oksydacja, podczas której zostaje wytworzony aktywny octan, a następnie jest włączany w cykl kwasów trójkarboksylowych (etap drugi) z wytworzeniem produktów końcowych – dwutlenku węgla oraz wody [18,58]. Zaktywowane LCFA w mniejszym stopniu (10-30%) mogą również tworzyć wewnątrzkomórkową pulę kwasów tłuszczowych z udziałem acylotransferazy glicerolofosforanowej, tworząc wewnątrzkomórkowe zasoby mono-, di- i triacylogliceroli, uwalnianianych w razie zaistnienia zapotrzebowania na LCFA [96].
Jak już wspomniano, drugim pod względem wielkości substratem energetycznym wykorzystywanym przez mię- sień sercowy jest glukoza. Wykazano, że transport glukozy do wnętrza kardiomiocytów odbywa się z udziałem błonowych transporterów GLUT. W metabolizm glukozy w mięśniu sercowym są zaangażowane transportery GLUT1 (przeważając w okresie płodowym) i GLUT4 [18,32]. Transportery GLUT1 są umiejscowione głównie w błonie komórkowej i nie wykazują wrażliwości na stymulację insuliną [32]. Natomiast transportery GLUT4 znajdują się głównie wewnątrz komórki w pęcherzykach mikrosomalnych. Translokacja GLUT4 na powierzchnię błony komórkowej zachodzi podczas stymulacji przez róż- ne czynniki, wśród których wymienić należy insulinę, niedokrwienie oraz przeciążenie serca (overload) [32]. W warunkach fizjologicznych w sercu występuje również niska ekspresja transportera GLUT3 [20]. Oprócz wymienionego transportu istnieje również kotransport sodu i glukozy z udziałem transportera SGLT1, reagującego na stymulację insuliną oraz leptyną [2]. Glukoza po wejściu do wnętrza komórki w wyniku procesu glikolizy przekształcana zostaje w pirogronian. W warunkach tlenowych pirogronian pod wpływem enzymu dehydrogenazy pirogronianowej (PDH) przekształca się do acetylo-CoA, który jest włączany do cyklu kwasów trójkarboksylowych (Krebsa). Przy braku dostępności tlenu dehydrogenaza pirogronianowa (LDH) powoduje powstawanie mleczanu z pirogronianu, jednak należy podkreślić, iż procesy glikolizy beztlenowej w mięśniu sercowym są znikome [18].
Wpływ endokannabinoidów na metabolizm mięśnia sercowego
Pobór substratów energetycznych przez mięsień sercowy zależy od wielu czynników, wśród których wymienić należy: stężenie docierających do kardiomiocytów substratów, wpływ hormonów regulujących metabolizm (m.in. insulina), zapotrzebowanie serca na energię (wysiłek fizyczny, tachykardia, wzrost obciążenia następczego) oraz zaopatrzenie miokardium w tlen [96]. Pośrednio lub bezpośrednio każdy czynnik może aktywować układ endokannabinoidowy. Brak jest danych literaturowych opisujących bezpośredni wpływ endokannabinoidów na metabolizm miokardium. Ponieważ receptory tego układu są umiejscowione nie tylko na powierzchni kardiomiocytów, ale również występują na zakończeniach włókien współczulnych autonomicznego układu nerwowego unerwiającego serce, z tego można wnioskować, iż endokannabinoidy są zaangażowane w metabolizm mięśnia sercowego w sposób bezpośredni. Możliwe jest również, że endokannabinoidy wykazują wpływ pośredni, modulując transmisję neuronalną przez umiejscowione w ośrodkowym i obwodowym układzie nerwowym komponenty tego układu, wpływając na podwzgórzową regulację poboru pokarmu, metabolizm substratów energetycznych w wątrobie i ostatecznie zmieniając przepływ wieńcowy [15,48].
Pośredni wpływ endokannabinoidów na metabolizm mięśnia sercowego
Wiele danych doświadczalnych dowodzi wpływu układu endokannabinoidowego na wzmożone łaknienie [9,15,35,49]. Działanie to jest możliwe przez wpływ na receptory CB1 obecne w obrębie podwzgórza (jądro przykomorowe i jądro łukowate podwzgórza). W badaniach przeprowadzonych na szczurach udowodniono, że przez bezpośrednią iniekcję anandamidu do podwgórza można wywołać uczucie głodu [49]. Ponadto endokannabinoidy aktywując receptory CB1 w podwgórzu działają na uwalnianie peptydów oreksygenicznych regulujących pobieranie pokarmu, np. neuropeptyd Y, hormon melanocytotropowy czy preprooreksynę 1. Ekspresję receptorów CB1 stwierdzono również w neuronach podwzgórza wydzielających peptydy anoreksygeniczne, czyli zmniejszające łaknienie, m.in. kortykoliberynę, transkrypt regulowany przez kokainę i amfetaminę. Prawdopodobnie przez aktywację receptorów CB1 jest możliwe wpływanie na ich wydzielanie i tym samym regulację apetytu [15,35,49].
Aktywacja receptorów CB1 w obrębie układu mezolimbicznego reguluje nie tylko łaknienie, ale bierze też udział w procesach motywacji i aktywacji behawioralnej w wyniku zadziałania czynnika nagradzającego (konsumpcji pokarmu) [9,15]. W badaniu przeprowadzonym na zdrowych ochotnikach wykazano, że konsumpcji ulubionych potraw w porównaniu do potraw o neutralnych walorach smakowych towarzyszy wzrost stężenia 2-arachidonyloglicerolu w osoczu, który pozytywnie koreluje z osoczowym stężeniem greliny [71]. Wynik eksperymentu może świadczyć o prawdopodobnym zaangażowaniu aktywacji układu endokannabinoidowego w występowanie hiperfagii hedonicznej, czyli spożywania pokarmów dla przyjemności, a nie w celu utrzymania homeostazy energetycznej [71]. Nadmierna podaż pokarmu przyczynia się do wzrostu dostępności substratów energetycznych w osoczu, co istotnie wpływa na energetykę mięśnia sercowego, ponieważ duże stężenie krążących kwasów tłuszczowych bezpośrednio wzmaga dokomórkowy napływ LCFA do kardiomiocytów. Mimo iż kwasy tłuszczowe są podstawowym źródłem energii dla miokardium to wzrost ich metabolizowania wywiera negatywne skutki. Dzieje się tak dlatego, że wraz ze wzrostem oksydacji kwasów tłuszczowych jako substratu energetycznego maleje udział glukozy (a także mleczanów) w przemianach metabolicznych kardiomiocytów. Powyższa zmiana w metabolizmie miokardium zmniejsza wydolność mechaniczną serca, a także zwiększa ilość zu- żywanego tlenu do wygenerowania ATP niezbędnego do skurczu [96]. Ponadto w doświadczeniu przeprowadzonym na myszach wykazano, że nawet podczas 3-dniowego zastosowania diety bogatej w tłuszcze dochodzi do przejściowego wzrostu poziomu 2-arachidonyloglicerolu w podwzgórzu [44]. Natomiast w przypadku wydłużenia okresu stosowania tej diety do 14 dni, stwierdzono trwały wzrost 2-arachidonyloglicerolu w podwzgórzu [44]. W obydwu opisanych doświadczeniach zauważono zwiększenie preferencji do spożywania pokarmów obfitujących w tłuszcze, ustępujące po zastosowaniu antagonisty receptora CB1. Informacje te wskazują, że w wyniku nadmiernej aktywacji receptorów CB1 pod wpływem podwyższonego stężenia 2-arachidonyloglicerolu może wystąpić skłonność do konsumpcji pokarmów wysokotłuszczowych [44]. W wyniku spożywania zwiększonej ilości tłuszczów w diecie wzrasta stężenie krążących wolnych kwasów tłuszczowych, co w rezultacie wpłynie na zwiększenie dostępności tego substratu energetycznego dla kardiomiocytów. Di Marzo i wsp. [26] w badaniach na zwierzętach wykazali ponadto, że w podwzgórzu występuje pewien rodzaj sprzężenia zwrotnego między 2-AG a leptyną. Zauważono bowiem, że podwyższonemu stężeniu 2-AG towarzyszy upośledzenie sygnału przekazywanego przez leptynę u otyłych myszy db/db i ob/ob i szczurów Zucker [26]. Natomiast jednorazowe podanie leptyny redukuje stężenie 2-AG u myszy ob/ob i szczurów bez mutacji genetycznej [26]. Powyż- sze odkrycie wskazuje na udział 2-AG w podwzgórzu jako komponenty wchodzącej w skład obwodów neuronalnych regulowanych przez leptynę. Ponadto toniczne pobudzanie receptorów CB1 przez 2-AG najprawdopodobniej ma na celu podtrzymanie pobierania pokarmu [26]. Sugeruje się, że podwyższone stężenie 2-AG i towarzyszące mu zaburzenia w szlaku leptynowym [26] mogą mieć udział w obwodowych zaburzeniach metabolicznych, np. w wą- trobowej oporności na insulinę [77]. Wykazano, że aktywacja receptorów CB1 w obrębie ośrodkowego układu nerwowego u szczurów z infuzją agonistów receptorów CB1 – WIN55,212-2 (WIN) lub arachidonoilo-2-chloroetylamidu (ACEA) do komór mózgu hamuje zależną od insuliny supresję wątrobowego wytwarzania glukozy, co powoduje nadmierne wytwarzanie glukozy przez wątrobę [77]. Zaobserwowane zahamowanie supresji wątrobowej wytwarzanej glukozy nie wynika ze zmian w wewnątrzkomórkowym szlaku insulinowym w wątrobie, ponieważ zarówno ekspresja, jak i fosforylacja istotnych składowych tego szlaku – kinazy białkowej AKT oraz kinazy syntazy glikogenu 3 – GSK3 w wątrobie nie zmieniły się pod wpływem WIN i ACEA [77]. Najprawdopodobniej zahamowanie zależnego od insuliny, wątrobowego wytwarzania glukozy pod wpływem WIN i ACEA jest wynikiem zaburzeń w szlaku insulinowym i leptynowym na poziomie ośrodkowego układu nerwowego, przy czym mechanizm ten nie został wyjaśniony [56]. Ponadto w wyniku centralnej aktywacji receptorów CB1 upośledzona zostaje zdolność insuliny do hamowania ogólnoustrojowej lipolizy białej tkanki tłuszczowej (WAT – white adipose tissue) wskutek zwiększenia ekspresji i fosforylacji białka przenoszącego lipidy – perilipiny oraz koaktywatora lipazy triacyloglicerolowej (ATGL – adipose triglyceride lipase) – CGI-58 (comparative gene identification-58) [77]. Dochodzi także do wzrostu ekspresji głównych enzymów lipolitycznych w WAT – ATGL i lipazy hormonowrażliwej (HSL – hormone-sensitive lipase). Uwolniony z WAT glicerol może stanowić podłoże do glukoneogenezy w wątrobie, zwiększając tym samym stężenie glukozy we krwi i mechanizm obserwowanej w wątrobie oporności na insulinę [77]. Zwiększona lipoliza przyczynia się do podwyższenia stężenia krążących wolnych kwasów tłuszczowych, a przez to do wygenerowania lipotoksyczności, która jest jednym z czynników patogenetycznych w rozwoju cukrzycy typu 2. Powyższe zmiany wpływają na zwiększenie dostępności substratów energetycznych dla wszystkich komórek, w tym również dla kardiomiocytów. Zwiększenie osoczowej biodostępności glukozy i kwasów tłuszczowych zwiększa dokomórkowy transport tych substratów energetycznych do wnętrza kardiomiocytów [26,77,93].
Ze względu na obecność receptorów endokannabinoidowych w obrębie tkanek i narządów obwodowych o znacznej aktywności metabolicznej, endokannabinoidy wpływają na gospodarkę energetyczną ustroju także poza ośrodkowym układem nerwowym. Wykazano, że u myszy szczepu dzikiego obecne w dojrzałych adipocytach receptory CB1 w wyniku aktywacji w warunkach in vitro powodują zwiększenie syntezy kwasów tłuszczowych de novo, wewnątrzkomórkową akumulację triglicerydów oraz zmniejszenie lipolizy [101]. Podłożem zmian jest pobudzenie wychwytu glukozy i aktywacja enzymu lipogenezy, tj. syntazy kwasów tłuszczowych (FAS – fatty acid synthase). Prawdopodobnie prowadzi to do zmniejszenia stężenia wolnych kwasów tłuszczowych i glukozy we krwi. Ponadto, w wyniku aktywacji receptora CB1 dochodzi do zahamowania śródbłonkowej syntazy tlenku azotu i następczego spadku biogenezy i aktywności enzymów mitochondrialnych w adipocytach [101].
Stwierdzono, że receptory CB1 znajdujące się na zakończeniach nerwowych przewodu pokarmowego pod wpływem anandamidu stymulują łaknienie, wpływając tym samym na zwiększenie pobierania pokarmu i wzrost dostępnych w ustroju substratów energetycznych [15]. Przypuszcza się, że endokannabinoidy hamują opróż- nianie żołądka oraz zmniejszają perystaltykę jelit, co również sprzyja zwiększonemu wchłanianiu substratów energetycznych do krwiobiegu. Obecność receptorów CB1 w wątrobie, mimo iż występują w niewielkiej ilości, wpływa na możliwość regulowania metabolizmu glukozy przez endokannabinoidy. Wykazano, że systemowa blokada receptorów CB1 przez antagonistę AVE1625 u szczurów wywołuje wzrost wątrobowej glikogenolizy, co świadczy o prawdopodobnym udziale aktywacji receptorów CB1 w tworzeniu glikogenu w wątrobie [42]. Być może centralna aktywacja receptorów CB1 ma na celu dostarczenie substratów energetycznych dla organizmu, natomiast aktywacja obwodowych receptorów CB1 sprzyja efektywnemu gromadzeniu pozyskanych źródeł energii [24].
Przez obecność receptorów CB1 i CB2 w komórkach β trzustki endokannabinoidy mogą wpływać na metabolizm regulując wydzielanie insuliny. Nie jest jednak pewne, czy aktywacja receptorów CB1 kontroluje tylko sygnał przekazywany przez insulinę czy wpływa na jej wydzielanie [95]. Liu i wsp. [56] w badaniach przeprowadzonych na ludzkich i mysich hepatocytach sugerują, że aktywacja receptorów CB1 pod wpływem anandamidu powoduje zahamowanie sygnału przekazywanego przez insulinę w dwojaki sposób. Indukuje fosforylację seryny w pozycji 307 substratu receptora insuliny typu 1 (IRS1 – insulin receptor substrate 1), co wpływa na zahamowanie aktywności kinazy białkowej B (AKT2). Aktywacja receptorów CB1 wpływa bezpośrednio na zahamowanie indukowanej insuliną fosforylacji AKT2. Kinaza AKT2 będąc w postaci nieufosforylowanej jest nieaktywna i tym samym hamowany jest szlak insulinowy [56]. Główną funkcją AKT2 jest aktywacja kaskady reakcji prowadzących do zwiększenia translokacji transporterów GLUT4 z puli wewnątrzkomórkowej do błony komórkowej pod wpływem stymulacji insuliną [38]. Oznacza to, że glukoza mimo obecności insuliny nie może zostać przetransportowana do wnętrza hepatocytów [56]. Esposito i wsp. [31] w badaniu przeprowadzonym na hodowli C6 komórek mięśni szkieletowych myszy również zauważyli, że układ endokannabinoidowy wpływa ujemnie na regulację szlaków insulinowych P13K-AKT, a także P13K-PDK-PKCξ, których udział jest niezbędny w wychwycie glukozy z udziałem transporterów GLUT4 [95]. Dowiedziono, że komórki α wysp trzustki wytwarzają enzymy biorące udział w syntezie endokannabinoidów, natomiast komórki β syntetyzują enzymy degradujące endokannabinoidy [97]. Zanim endokannabinoidy ulegną hydrolizie, mogą zaktywować receptory CB2 występujące w komórkach β trzustki i spowodować zahamowanie wydzielania insuliny [97]. Ponadto anandamid działając na receptory waniloidowe TRPV1, które są sprzężone z komórkami β trzustki, również wpływa na ich czynność wydzielniczą [97]. Endokannabinoidy przez zahamowanie szlaków insulinowych, a także translokacji transporterów glukozy prawdopodobnie mogą wpłynąć na zmniejszenie stężenia glukozy wewnątrz kardiomiocytów, a tym samym spadek metabolizmu tego substratu energetycznego w miokardium.
Podsumowując wydaje się, że wpływ aktywacji układu endokanabinoidowego na metabolizm jest zarówno ośrodkowy (ogólnoustrojowy) jak i miejscowy (narządowy) (ryc. 1).
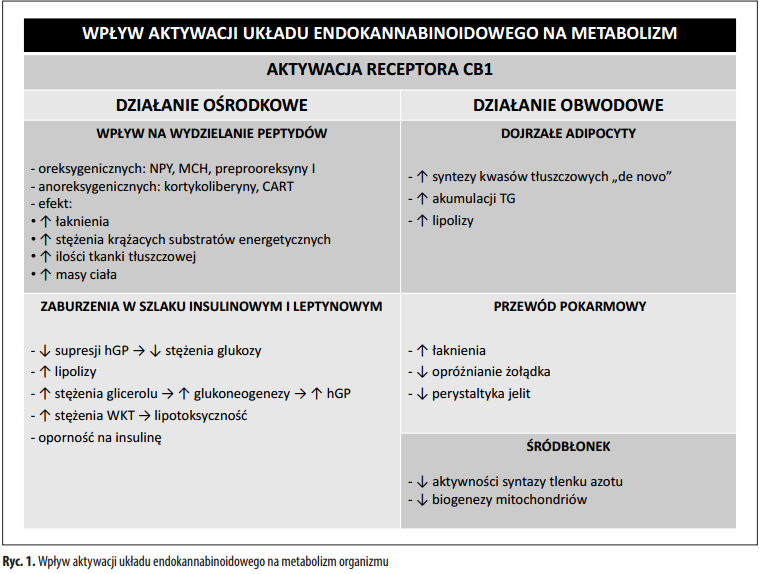
Endokannabinoidy w otyłości
Obecnie wiele badań wskazuje, że rozwojowi otyłości towarzyszy aktywacja układu endokannabinoidowego [11,24,37,57,65,66]. Świadczy o tym m.in. występująca u myszy dysregulacja układu endokannabinoidowego powstała w wyniku otyłości wyindukowanej dietą wysokotłuszczową, która objawia się wczesnym i trwałym wzrostem ekspresji anandamidu i 2-AG w wielu tkankach obwodowych, m.in. w sercu [67]. Ze względu na ich właściwości lipogeniczne i jednoczesny wzrost ekspresji receptorów CB1 w sercu może dojść do wzmożenia lipogenezy [67]. Nadmierna lipogeneza może się przyczynić do stłuszczenia osierdzia, co stanowi jeden z czynników ryzyka chorób sercowo-naczyniowych [24,67]. Przeprowadzono także badania mające na celu stwierdzenie czy możliwa jest supresja stymulowanej przez układ endokannabinoidowy lipogenezy. W badaniach tych wykazano, że długotrwałe zablokowanie receptorów CB1 w WAT przez rimonabant zwiększa utlenianie kwasów tłuszczowych i wydatek energetyczny u myszy z otyłością wywołaną dietą wysokotłuszczową [50]. Prawdopodobnie rimonabant wpływa na zwiększenie ekspresji enzymów w WAT zaangażowanych w utlenianie kwasów tłuszczowych [50]. Przeprowadzono też eksperyment na genetycznym modelu otyłości – u szczurów Zucker, któ- rym także podawano rimonabant [69]. Inhibicja receptorów CB1 przyczyniła się do spadku masy ciała, hamowania procesu akumulacji tkanki tłuszczowej, wzrostu wrażliwości na insulinę, zwiększonej aktywności układu współczulnego, a także wzrostu stężenia adiponektyny oraz zmniejszenia ciśnienia krwi [57,69]. Z powyższych doświadczeń wynika, że skutki nadmiernej aktywacji układu endokannabinoidowego mogą być łagodzone przez antagonistę receptorów CB1 zarówno w otyłości wynikającej z nieprawidłowej diety, jak i otyłości spowodowanej czynnikami genetycznymi.
Niemniej interesującym wydaje się badanie, w którym wykazano, że aktywność enzymu FAAH w dojrzałych adipocytach pozytywnie koreluje ze wzrostem wskaźnika masy ciała (BMI – body mass indeks) i obwodem talii u zdrowych osób [11]. Prawdopodobnie wzrost aktywności enzymu FAAH jest wynikiem ogólnego wzrostu aktywności układu endokanabinoidowego w czasie rozwoju otyłości. Jednocześnie obserwacja potwierdza hipotezę, że niektó- re składowe układu endokannabinoidowego są pobudzane w wyniku pojawienia się chorób, m.in. otyłości [11].
Endokannabinoidy w cukrzycy
Podobnie jak w otyłości, istnieje wiele badań wskazują- cych, że aktywacja receptorów CB1 sprzyja rozwojowi cukrzycy typu 2 [57]. Liu i wsp. w badaniach na myszach zauważyli, że po zastosowaniu ich blokera – rimonabantu nastąpiło zwiększenie wychwytu i metabolizmu glukozy, m.in. w mięśniach szkieletowych, co jednocześnie wskazuje na zależne od aktywacji receptorów CB1 zaburzenie przemian metabolicznych glukozy [57]. W celu wyjaśnienia molekularnego mechanizmu zaburzeń metabolizmu glukozy warto jest zwrócić uwagę na wyniki doświadczenia przeprowadzonego przez Motaghediego i wsp. [72]. Wykazali związek między zastosowaniem antagonisty receptorów CB1 a zwiększeniem translokacji transportera glukozy GLUT4 z kompartmentu wewnątrzkomórkowego do błony komórkowej w adipocytach [72]. Oznacza to, że aktywacja receptorów CB1 hamuje translokację transportera GLUT4, a dane literaturowe wskazują, że opisany mechanizm występuje również m.in. w komórkach mięśni szkieletowych [47], co nie wyklucza udziału hamowania translokacji GLUT4 przez zaktywowane receptory CB1 w kardiomiocytach. W wyniku spadku liczby błonowych transporterów glukozy wychwyt glukozy z krwi do komó- rek ulega zmniejszeniu, prowadząc do spadku intensywności metabolizowania glukozy w komórkach. Ponadto badaniom poddano wpływ układu endokannabinoidowego w rozwoju cukrzycy typu 1 [85]. Rajesh i wsp. dowiedli, że cukrzyca typu 1 doprowadza do wzrostu ekspresji receptorów CB1 i wzrostu stężenia anandamidu w sercu myszy [85]. Ponadto dysfunkcja mięśnia sercowego powstająca w przebiegu cukrzycy ulega poprawie u myszy CB1-/- oraz u myszy nieznokautowanych leczonych antagonistami receptorów CB1 [85]. Genetyczna delecja lub farmakologiczna inhibicja receptorów CB1 osłabia aktywację MAPK, zmniejsza apoptozę komórek, stan zapalny oraz stres oksydacyjny i nitrozacyjny obejmujący miokardium myszy z cukrzycą [85]. Wyniki badań otrzymanych Podobnie jak w otyłości, istnieje wiele badań wskazują- cych, że aktywacja receptorów CB1 sprzyja rozwojowi cukrzycy typu 2 [57]. Liu i wsp. w badaniach na myszach zauważyli, że po zastosowaniu ich blokera – rimonabantu nastąpiło zwiększenie wychwytu i metabolizmu glukozy, m.in. w mięśniach szkieletowych, co jednocześnie wskazuje na zależne od aktywacji receptorów CB1 zaburzenie przemian metabolicznych glukozy [57]. W celu wyjaśnienia molekularnego mechanizmu zaburzeń metabolizmu glukozy warto jest zwrócić uwagę na wyniki doświadczenia przeprowadzonego przez Motaghediego i wsp. [72]. Wykazali związek między zastosowaniem antagonisty receptorów CB1 a zwiększeniem translokacji transportera glukozy GLUT4 z kompartmentu wewnątrzkomórkowego do błony komórkowej w adipocytach [72]. Oznacza to, że aktywacja receptorów CB1 hamuje translokację transportera GLUT4, a dane literaturowe wskazują, że opisany mechanizm występuje również m.in. w komórkach mięśni szkieletowych [47], co nie wyklucza udziału hamowania translokacji GLUT4 przez zaktywowane receptory CB1 w kardiomiocytach. W wyniku spadku liczby błonowych transporterów glukozy wychwyt glukozy z krwi do komó- rek ulega zmniejszeniu, prowadząc do spadku intensywności metabolizowania glukozy w komórkach. Ponadto badaniom poddano wpływ układu endokannabinoidowego w rozwoju cukrzycy typu 1 [85]. Rajesh i wsp. dowiedli, że cukrzyca typu 1 doprowadza do wzrostu ekspresji receptorów CB1 i wzrostu stężenia anandamidu w sercu myszy [85]. Ponadto dysfunkcja mięśnia sercowego powstająca w przebiegu cukrzycy ulega poprawie u myszy CB1-/- oraz u myszy nieznokautowanych leczonych antagonistami receptorów CB1 [85]. Genetyczna delecja lub farmakologiczna inhibicja receptorów CB1 osłabia aktywację MAPK, zmniejsza apoptozę komórek, stan zapalny oraz stres oksydacyjny i nitrozacyjny obejmujący miokardium myszy z cukrzycą [85]. Wyniki badań otrzymanych przez Rejesha i wsp. dotyczące wzrostu ekspresji receptorów CB1 i stężenia anandamidu w lewej komorze serca myszy z cukrzycą typu 2 są zgodne z wynikami wzrostu stężenia anandamidu w ludzkiej siatkówce oka objętej retinopatią cukrzycową [68,85]. Powyższe wyniki dowodzą ogólnoustrojowego wpływu układu endokannabinoidowego na organizm podczas cukrzycy.
Endokannabinoidy a układ krążenia
Endokannabinoidy in vivo mają bezpośredni wpływ na układ sercowo-naczyniowy [17]. Badania przeprowadzone na szczurach dowiodły, że anandamid może wywoływać zmiany hemodynamiczne występujące w postaci trzech faz [63]. W fazie I dochodzi do jednoczesnej aktywacji receptorów TRPV1 i wystąpienia bradykardii oraz hipotensji. W fazie II następuje krótkotrwała odpowiedź presyjna. Sugeruje się, że faza ta ma złożony mechanizm, w którym są angażowane struktury ośrodkowe (receptory ß-adrenergiczne i NMDA) i obwodowe (naczynia krwionośne; mechanizm zależny od kanałów wapniowych). Prawdopodobnie w tej fazie dochodzi również do aktywacji receptorów TRPV1. W fazie III obserwuje się wydłużoną hipotensję, w której udział biorą receptory CB1 znajdujące się w naczyniach krwionośnych oraz w sercu. Ich aktywacja prowadzi do zahamowania zarówno odpowiedzi presyjnej, jak i tachykardii [63]. Ponadto wykazano wpływ metabolitu anandamidu powstałego w wyniku hydrolizy pod wpływem enzymu FAAH na kanały potasu zależne od ATP (KATP) w izolowanych szczurzych kardiomiocytach komór serca [55]. Powstały podczas hydrolizy anandamidu kwas arachidonowy wpływa na aktywację kana- łów KATP w szczurzych kardiomiocytach [55]. Kanały te są odpowiedzialne za metabolizm energetyczny komórek, tzn. reagują na zmiany wewnątrzkomórkowego stosunku ATP/ADP i są zamykane gdy stosunek ten wzrasta. Ich otwarcie następuje pod wpływem obniżenia wewnątrzkomórkowej zawartości ATP oraz spadku ekspresji kana- łów potasu zależnych od acetylocholiny (KAch). Otwarcie kanałów potasowych powoduje wypływ jonów potasu z komórki i następczą repolaryzację błony komórkowej kardiomiocytów. Aktywacja kanałów KATP przez metabolit anandamidu ma znaczenie antyarytmiczne i kardioprotekcyjne podczas niedotlenienia mięśnia sercowego [55]. Otwarcie kanałów KATP skraca czas trwania potencja- łu czynnościowego kardiomiocytów i zmniejsza dopływ wapnia przez kanały typu L, co zapobiega nadmiernemu wzrostowi stężenia wapnia w sercu i utrzymuje ilość ATP w kardiomiocytach na odpowiednim poziomie [55]. Układ endokannabinoidowy nie wykazuje tonicznej aktywności w warunkach fizjologicznych w obrębie układu krążenia. Zauważono natomiast, że w procesach patologicznych kompensuje zmiany w parametrach krążenia, m.in. przez zmiany w wydzielaniu endokannabinoidów i ekspresji receptorów endokannabinoidowych [10,62,63,80].
Endokannabinoidy w nadciśnieniu
Wyniki badań wskazują na wpływ aktywacji receptorów CB1 przez endokannabinoidy na obniżenie ciśnienia tętniczego krwi w nadciśnieniu tętniczym u szczurów [10]. W różnych postaciach nadciśnienia tętniczego (samoistnego, nerkopochodnego) występuje toniczna aktywacja układu endokannabinoidowego za co prawdopodobnie odpowiada zwiększona ekspresja receptorów CB1 w sercu i komórkach endotelialnych naczyń krwionośnych [10]. W doświadczeniu przeprowadzonym na szczurach z nadciśnieniem samoistnym (SHR – spontaneously hypertensive rat) stwierdzono, że zwiększona ekspresja receptorów CB1 w kardiomiocytach i komórkach endotelialnych aorty szczurów SHR w porównaniu do szczurów normotensyjnych przekłada się na wzrost działania hipotensyjnego w odpowiedzi na podanie kannabinoidów pochodzenia egzogennego u szczurów SHR [10]. Ponadto zwiększenie aktywacji receptorów CB1 przez zablokowanie degradacji i wewnątrzkomórkowego wychwytu zwrotnego anandamidu normalizuje ciśnienie krwi, o czym świadczy wpływ inhibicji enzymu FAAH przez URB597 u szczurów SHR na zmniejszenie ciśnienia krwi oraz czynności serca do poziomu obserwowanego u zwierząt normotensyjnych. Dodatkowych informacji na temat zależności występujących między nadciśnieniem a układem endokannabinoidowym dostarczyło zastosowanie antagonisty receptorów CB1 – SR141716 u szczurów SHR. U szczurów z nadciśnieniem samoistnym zastosowanie SR141716 wywołuje trwały dalszy wzrost ciśnienia krwi, co sugeruje że prawdopodobnie podniesione podstawowe ciśnienie krwi wpływa na toniczną aktywację receptorów CB1 [10]. Ponadto antagoniści receptorów CB1 zwiększają wydolność skurczową serca bez znaczącego wpływu na obwodowy opór naczyniowy, co może oznaczać, że endokannabinoidy podczas nadciśnienia działają głównie na serce [10]. Antagoniści receptora CB1 oraz inhibitory FAAH zastosowane u szczurów normotensyjnych nie wywoływały żadnego działania. Wyniki tych badań mogą świadczyć o widocznej aktywacji układu endokannabinoidowego w układzie krążenia w stanie hipertensji, a zastosowanie agonistów receptorów CB1 i inhibitorów agonistów receptorów CB1 przyczynia się do normalizacji ciśnienia tętniczego krwi [10].
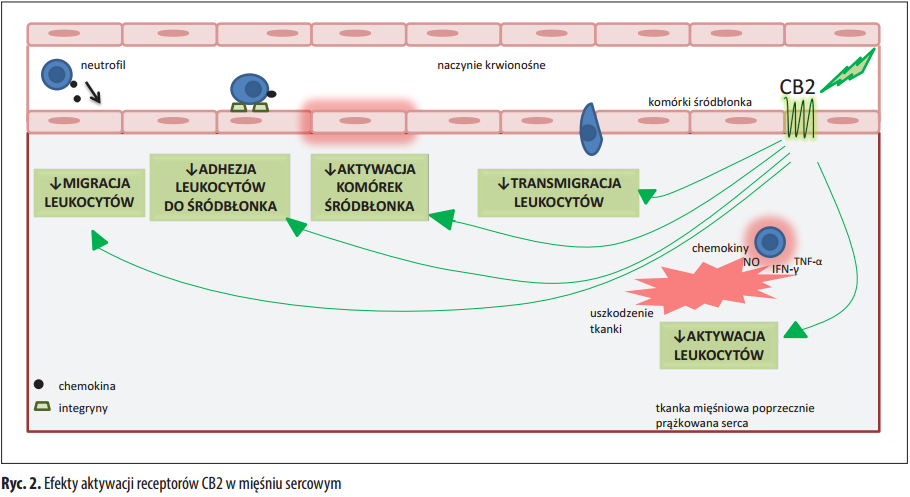
Endokannabinoidy w niedokrwieniu i zawale mięśnia sercowego
Z dotychczas przeprowadzonych badań wynika, że endokannabinoidy wykazują właściwości kardioprotekcyjne. W eksperymencie przeprowadzonym na szczurach dowiedziono, że 2-AG i PEA podczas niedokrwienia mięśnia sercowego zmniejszają w istotny sposób obszar uszkodzenia tkanki [60]. Jednocześnie zmniejszeniu uległo stężenie enzymów uwolnionych z kardiomiocytów – kinazy kreatynowej i dehydrogenazy mleczanowej [60]. Ponadto w mysim modelu niedokrwienia i reperfuzji miokardium wykazano, że stężenie troponiny I pochodzą- cej z kardiomiocytów objętych martwicą jest znacznie mniejsze w przypadku zastosowania agonistów receptorów CB2 [70]. Prawdopodobnie aktywacja receptorów CB2 przyczynia się do „hartowania” serca niedokrwieniem (preconditioning), czyli zabezpiecza kardiomiocyty przed nekrozą w wyniku niedokrwienia oraz następczej reperfuzji [60]. W doświadczeniu przeprowadzonym na myszach, u których wyidukowano zawał mięśnia sercowego dowiedziono, że aktywacja receptorów CB2 zmniejsza migrację leukocytów w miejsce uszkodzonej tkanki [22]. Dochodzi do zmniejszenia możliwości zachodzenia interakcji między leukocytami a śródbłonkiem, a tym samym obniżeniu ulega prawdopodobieństwo wystąpienia dodatkowego uszkodzenia przez zaktywowane komórki układu odpornościowego [22]. Wykazano także, że aktywacja receptorów CB2 przyczynia się do zmniejszonego wytwarzania reaktywnych form tlenu przy zmniejszeniu infiltracji neutrofili w obrębie komór serca po zawale [70].
Endokannabinoidy wykazują właściwości kardioprotekcyjne, ale istnieją dowody na ich negatywny wpływ na układ krążenia. Wykazano, że pobudzenie receptorów CB1 przez AEA w ludzkich komórkach śródbłonka tętnic wieńcowych skutkuje zależną od dawki oraz czasu stymulacją aktywacji szlaków p38 i JNK-MAPK, wzrostem wytwarzania reaktywnych form tlenu oraz śmiercią komórek głównie w wyniku apoptozy [88]. Ponieważ zaktywowane receptory CB1 przez stymulację szlaków p38 i JNK-MAPK promują odpowiedź zapalną, a zaktywowane receptory CB2 wpływając na zmniejszenie ekspresji cytokin prozapalnych hamują chemotaksję i aktywację leukocytów tłumiąc reakcje immunologiczne [88] nasuwa się wniosek: w chwili powstania niedokrwienia mię- śnia sercowego w komórkach śródbłonka zaktywowane receptory CB1 i CB2 pełnią przeciwstawną w stosunku do siebie funkcję – receptory CB1 prozapalną, natomiast receptory CB2 przeciwzapalną. Jednocześnie warto zauważyć, że zastosowanie agonisty receptorów CB2 i/lub antagonisty receptorów CB1 może wpłynąć ochronnie na poddane niedokrwieniu kardiomiocyty. Quercioli i wsp. w badaniu dotyczącym określenia zależności między stę- żeniem endokannabinoidów a występowaniem dysfunkcji w krążeniu wieńcowym u ludzi otyłych [84] stwierdzili, że podwyższone stężenie anandamidu i 2-AG w osoczu wykazuje pozytywną korelację ze zmniejszonym przepływem krwi przez miokardium u osób otyłych w porównaniu do osób o prawidłowej masie [84]. Prawdopodobobnie pod wpływem nadmiernej aktywacji układu endokannabinoidowego dochodzi do nieprawidłowości w funkcjonowaniu śródbłonka i komórek mięśni gładkich tętniczek wieńcowych, co przekłada się na zauważone w doświadczeniu zmiany w przepływie krwi przez miokardium [84].
Podsumowanie
