Kannabidiol (CBD) to nie odurzający i ogólnie dobrze tolerowany składnik konopi indyjskich, który wykazuje potencjalne korzystne właściwości w leczeniu szerokiego zakresu chorób, w tym zaburzeń sercowo-naczyniowych. Ze względu na złożony mechanizm działania CBD może oddziaływać na układ sercowo-naczyniowy na różne sposoby. W związku z tym dokonaliśmy przeglądu wpływu CBD na ten układ w zdrowiu i chorobie, aby określić potencjalne ryzyko sercowo-naczyniowych skutków ubocznych podczas stosowania CBD w celach medycznych i wellness oraz wyjaśnić jego potencjał terapeutyczny w chorobach sercowo-naczyniowych. Podawanie CBD zdrowym ochotnikom lub zwierzętom zwykle nie wpływa znacząco na parametry hemodynamiczne. Chociaż stwierdzono, że CBD wykazuje właściwości rozszerzające naczynia krwionośne i przeciwutleniające w leczeniu nadciśnienia, nie wpływa to na ciśnienie krwi u zwierząt z nadciśnieniem. Hipotensyjne działanie CBD zostało ujawnione głównie w warunkach stresowych. Wiele pozytywnych efektów CBD zaobserwowano w eksperymentalnych modelach chorób serca (zawał mięśnia sercowego, kardiomiopatia, zapalenie mięśnia sercowego), udaru mózgu, niedotlenieniowo-niedokrwiennej encefalopatii niedokrwiennej mózgu, zapalenia mózgu związanego z sepsą, powikłań sercowo-naczyniowych cukrzycy oraz uszkodzeń niedokrwiennych/reperfuzyjnych wątroby i nerek. W tych stanach patologicznych CBD zmniejsza między innymi uszkodzenia i dysfunkcje narządów, stres oksydacyjny i nitratywny, procesy zapalne i apoptozę. Niemniej jednak potrzebne są dalsze badania kliniczne, aby zalecić stosowanie CBD w leczeniu chorób sercowo-naczyniowych.
1. Wstęp
Cannabis sativa była używana od czasów starożytnych do celów rolniczych, ceremonialnych i leczniczych. W medycynie tradycyjnej roślina ta stosowana była jako środek przeciwbólowy, przeciwdrgawkowy, przeciwastmatyczny, przeciwmalaryczny czy przeciwreumatyczny. Konopie indyjskie zawierają ponad 700 różnych substancji chemicznych, wśród których wyróżnia się grupa związków zwana kannabinoidami. Kannabinoidy znajdujące się w konopiach indyjskich nazywane są fitokannabinoidami. Oprócz kannabinoidów pochodzenia roślinnego istnieją również kannabinoidy wytwarzane endogennie u ludzi lub zwierząt (tzw. endokannabinoidy) oraz kannabinoidy syntetyczne [ 1 , 2 ]. Zidentyfikowano ponad 100 fitokannabinoidów, a dwa najbardziej znane z nich (dla porównania zob.Tabela 1) to Δ 9 -tetrahydrokannabinol (THC, a dokładniej jego izomer (-)-trans) i kannabidiol (CBD). THC jest głównym psychoaktywnym składnikiem konopi indyjskich, a ze względu na swoje działanie odurzające marihuana, haszysz i olej haszyszowy są powszechnie używanymi nielegalnymi narkotykami. Natomiast CBD jest ogólnie uważane za substancję nieodurzającą (w literaturze często określane jest jako „niepsychoaktywne”, może jednak modulować objawy niektórych zaburzeń neuropsychiatrycznych, dlatego też określenie „nieodurzający” ma tendencję do być preferowane), nie powodując uzależnienia ani poważnych skutków ubocznych [ 1 , 3 , 4 , 5 ]. Ponadto może modulować działanie THC, a zatem zmniejszać lub nasilać (w zależności od dawki i stosunku CBD:THC) skutki uboczne THC [ 6 , 7 ].
CBD jest uważany za psychoaktywny ze względu na jego działanie przeciwlękowe, przeciwpsychotyczne i przeciwdepresyjne; 2 tetrad kannabinoidów charakteryzuje się hipolokomocją, hipotermią, katalepsją i antynocycepcją wywołaną przez THC i inne psychoaktywne kannabinoidy (agoniści CB 1 ) u myszy; 3 na podstawie badań przedklinicznych i klinicznych; zarejestrowane wskazania (USA i/lub UE) obejmują wyłącznie spastyczność w stwardnieniu rozsianym (Sativex ® ), padaczkę lekooporną – zespół Draveta i zespół Lennoxa-Gastauta (Epidiolex ® ), nudności i wymioty wywołane chemioterapią (Marinol ® , Syndros ® , Cesamet® , Canemes® ) i anoreksję związaną z AIDS (Marinol® , Syndros® ) ; 4 CBD jest częściowym agonistą GPR18 o niskiej skuteczności i antagonizuje działanie THC (CBD działa jako antagonista); ↑/↓ – zwiększenie/zmniejszenie; (+) – agonista lub dodatni modulator allosteryczny; (–) – antagonista, odwrotny agonista lub negatywny modulator allosteryczny; skróty: 2-AG: 2-arachidonoiloglicerol; 5-HT 1A, 2A, 3 : receptory serotoninowe typu 1A, 2A, 3; Abn-CBD: nieprawidłowy kannabidiol; AEA: anandamid; BP: ciśnienie krwi; CB 1, 2 : receptor kannabinoidowy typu 1, 2; D2 : receptor dopaminowy typu 2; EMT: transporter błonowy endokannabinoidów; FAAH: hydrolaza amidu kwasu tłuszczowego; FABP-3,-5,-7: białko wiążące kwasy tłuszczowe 3, 5, 7; GABA A : receptor kwasu γ-aminomasłowego typu A; GPR3, 6, 12, 18, 55: receptor 3, 6, 12, 18, 55 sprzężony z białkiem G; HR: tętno; PPAR-γ: receptor γ aktywowany przez proliferatory peroksysomów; TRPA1: członek 1 podrodziny ankyryn o potencjale przejściowym; TRPM8: przejściowy potencjał receptora, członek podrodziny melastatyny 8; TRPV1-4: przejściowe potencjalne receptory, członkowie podrodziny waniloidów 1-4; α1-, α1β-, α3-GlyR: receptor α1, α1β-, α3-glicyny; α1 – AR: α1 – receptor adrenergiczny; δ-, μ-OR: δ-, μ-receptor opioidowy.
Badania podstawowe i/lub kliniczne wykazały, że kannabidiol ma wielokierunkowe działanie (Tabela 1), takie jak między innymi działanie przeciwutleniające, przeciwzapalne, immunomodulujące, przeciwartretyczne, przeciwdrgawkowe, neuroprotekcyjne, prokognitywne, przeciwlękowe, przeciwpsychotyczne i antyproliferacyjne. Tym samym CBD posiada szeroki potencjał terapeutyczny, który obejmuje m.in. epilepsję, choroby neurodegeneracyjne (stwardnienie rozsiane, choroba Alzheimera, Parkinsona i Huntingtona), zaburzenia neuropsychiatryczne (depresja, zaburzenia lękowe, schizofrenia, zespół stresu pourazowego, zaburzenia ze spektrum autyzmu), zaburzenia żołądkowo-jelitowe. (nudności i wymioty, choroby zapalne jelit, zespół jelita drażliwego), choroby reumatyczne, choroba przeszczep przeciw gospodarzowi i nowotwory (omówione w innym miejscu: [ 5 , 6 , 17 , 30 , 31 , 32 , 33 ]). Jednakże większość tych wskazań wymaga dalszych badań w celu potwierdzenia skuteczności klinicznej.
Pierwszy lek wykorzystujący wyłącznie kannabidiol jako substancję czynną został zarejestrowany w czerwcu 2018 roku w USA pod nazwą Epidiolex ® (GW Pharmaceuticals, UK). Jest to preparat płynny zawierający CBD (100 mg/ml) pochodzenia roślinnego, wskazany do stosowania w leczeniu ciężkiej padaczki lekoopornej objawiającej się we wczesnym dzieciństwie, takiej jak zespół Draveta i zespół Lennoxa-Gastauta [ 28 ]. W Unii Europejskiej CBD ma obecnie status leku sierocego w przypadku kilku chorób, takich jak zespoły padaczkowe (wymienione powyżej i zespół Westa), asfiksja okołoporodowa, stwardnienie guzowate, choroba przeszczep przeciwko gospodarzowi i glejak (w połączeniu z THC w tym ostatnim przypadku) [ 34 ]. Z kolei w wielu krajach Europy dostępne są nabiximole (nazwa handlowa Sativex ® , GW Pharmaceuticals), czyli ekstrakt z konopi indyjskich zawierający CBD i THC w przybliżeniu w proporcji 1:1. Sativex ® podawany jest w postaci sprayu doustnego i został opracowany w celu łagodzenia objawów spastyczności u pacjentów ze stwardnieniem rozsianym [ 4 ]. Ponadto CBD i THC są obecne w marihuanie w różnych proporcjach, a do zastosowań medycznych opracowano pochodne (tzw. marihuana medyczna lub marihuana medyczna) [ 4 , 29 ]. Warto wspomnieć, że CBD występuje także w suplementach diety, kremach i balsamach do stosowania miejscowego oraz olejkach do waporyzacji [ 30,33 ] . Zwiększone zainteresowanie prozdrowotnymi i terapeutycznymi właściwościami tych produktów doprowadziło do ich powszechnego stosowania, co może wiązać się z potencjalnymi działaniami niepożądanymi lub interakcjami z współpodawanymi lekami.
Układ endokannabinoidowy, na który składają się endokannabinoidy, enzymy ich syntetyzujące i metabolizujące oraz receptory kannabinoidowe (CB 1 i CB 2 ) występuje w układzie sercowo-naczyniowym. Zarówno endogenne, jak i egzogenne kannabinoidy wywołują zmiany w układzie sercowo-naczyniowym ludzi i zwierząt [ 19 , 20 , 35 ]. Powikłania sercowo-naczyniowe, takie jak tachykardia i ostre incydenty wieńcowe, są powszechnie kojarzone z paleniem marihuany (skutki zależne głównie od THC) lub przyjmowaniem syntetycznych kannabimimetyków jako składnika dopalaczy [ 36 ]. Z kolei CBD pozbawione jest niekorzystnego wpływu na układ sercowo-naczyniowy. Ponadto sugeruje się, że ma potencjał terapeutyczny w leczeniu chorób układu krążenia, takich jak udar, zawał mięśnia sercowego, zapalenie mięśnia sercowego, kardiomiopatie i powikłania sercowo-naczyniowe cukrzycy, co wiąże się z właściwościami rozszerzającymi naczynia, kardioprotekcyjnymi, przeciwutleniającymi, przeciwzapalnymi i neuroprotekcyjnymi. CBD [ 23 , 24 ].
2. Biosynteza i farmakologia kannabidiolu
2.1. Struktura i biosynteza
Kannabidiol (patrz struktura chemiczna,Tabela 1), podobnie jak inne kannabinoidy, należy do grupy C21 (lub C22 w przypadku form karboksylowanych) terpenofenoli. W postaci kwasowej (patrz poniżej) kannabidiol jest głównym składnikiem włóknistych odmian konopi [ 1 , 4 ]. Po raz pierwszy został wyizolowany z konopi indyjskich przez Adamsa i wsp. w Wielkiej Brytanii [ 37 ] oraz z haszyszu przez Jacoba i Todda w USA [ 38 ] w 1940 r. Jednak jego strukturę chemiczną określili dopiero w 1963 r. izraelscy naukowcy Mechoulam i Schvo [ 39 ], a konfigurację absolutną cztery lata później Mechoulam i Gaoni [ 40 ].
Biosynteza i magazynowanie kanabidiolu i innych fitokannabinoidów zachodzi w włoskach gruczołowych występujących głównie na kwiatach żeńskich. Mniejsze ilości fitokannabinoidów wykrywa się także w liściach, łodygach, nasionach, korzeniach czy pyłkach. Oprócz rodzaju tkanki, stężenia związków bioaktywnych w konopiach indyjskich zależą od odmiany, warunków wzrostu, etapu wzrostu, czasu zbiorów i warunków przechowywania [ 3 , 41 ].
Biosynteza fitokannabinoidów (Rysunek 1) rozpoczyna się od syntezy dwóch związków prekursorowych – difosforanu geranylu (GPP) w szlaku 4-fosforanu 2-metyloerytrytolu (MEP) i kwasu oliwetolowego (OA) w szlaku poliketydowym. Część terpenowa kannabinoidów pochodzi z GPP, który powstaje w wyniku kondensacji difosforanu izopentenylu (IPP) i difosforanu dimetyloallilu (DMAPP) katalizowanej przez syntazę GPP [ 1 , 42 ]. IPP i DMAPP są izomerami (ulegają wzajemnej transformacji pod wpływem izomerazy IPP) i są syntetyzowane w plastydach szlakiem MEP. Prekursorami MEP są pirogronian i aldehyd 3-fosfogliceryny. Szlak cytozolowego kwasu mewalonowego (MEV) może być również źródłem IPP i DMAPP, ale w przypadku syntezy kannabinoidów jest to prawdopodobnie niewielkie [ 42 , 43 ]. Drugim ważnym prekursorem kannabinoidów jest OA odpowiedzialna za ich ugrupowanie fenolowe. Powstaje w wyniku kondensacji aldolowej heksanoilo-CoA z trzema cząsteczkami malonylo-CoA, a do tej przemiany potrzebne są dwa enzymy – syntaza oliwetolowa i cyklaza kwasu oliwetolowego, działające na powstały produkt pośredni, tetraketydowy. Heksanoilo-CoA jest produktem reakcji pomiędzy heksanianem (powstającym w wyniku biosyntezy i/lub degradacji kwasów tłuszczowych) i CoA, katalizowanej przez syntetazę heksanoilo-CoA. Z drugiej strony malonylo-CoA jest produktem karboksylacji acetylo-CoA przez karboksylazę acetylo-CoA [ 42 ].
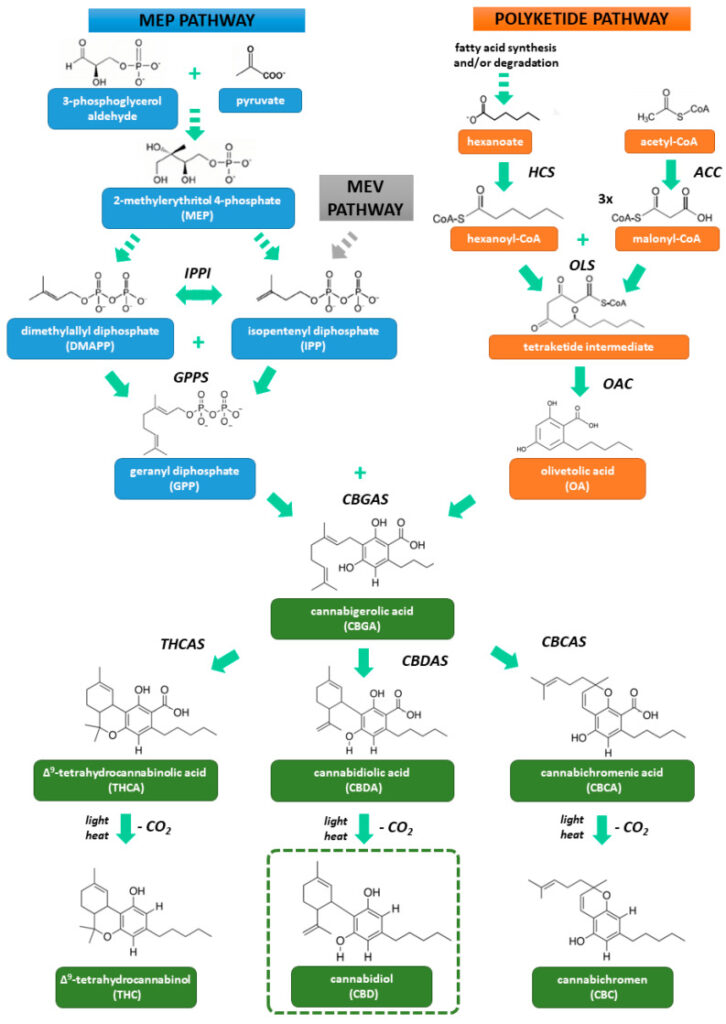
Rysunek 1
Biosynteza kannabidiolu i innych fitokannabinoidów [ 1 , 42 , 43 ]. Skróty: ACC: karboksylaza acetylo-CoA; CBCAS: syntaza kwasu kannabichromenowego; CBDAS: kwas kannabidiolowy i jego syntaza; CBGAS: syntaza kwasu kannabigerolowego; GPPS: syntaza difosforanu geranylu; HCS: syntetaza heksanoilo-CoA; IPP: difosforan izopentenylu; MEV: kwas mewalonowy; OAC: cyklaza kwasu oliwetolowego; OLS: syntaza oliwetolu; THCAS: syntaza kwasu Δ9 – tetrahydrokannabinolowego.
Fuzja OA i GPP powoduje powstanie kwasu kannabigerolowego (CBGA) katalizowanego przez jego syntazę. CBGA jest uważane za główny związek prekursorowy fitokannabinoidów. Syntaza kwasu kannabidiolowego przekształca CBGA w kwas kannabidiolowy (CBDA). Podobnie kwas tetrahydrokannabinolowy (THCA) i kwas kannabichromenowy (CBCA) powstają w wyniku ich specyficznych syntaz. Kwasowe typy kannabinoidów są podatne na światło i ciepło i w wyniku nieenzymatycznej dekarboksylacji przekształcają się w formy obojętne – CBD, THC i kannabichromen (CBC) [ 1 , 42 ]. Należy zaznaczyć, że formy obojętne występują w rosnącej roślinie w niskich stężeniach, a dopiero podczas obróbki cieplnej surowca (spalanie, pieczenie) tworzą się w dużych ilościach [ 44 ].
2.2. Mechanizm akcji
Kannabinoidy wywierają swoje działanie poprzez interakcję z receptorami kannabinoidowymi CB 1 i CB 2 , odkrytą na początku lat 90-tych. Są to receptory metabotropowe związane z białkami G i/o , których pobudzenie powoduje hamowanie cyklazy adenylowej i stymulację kinaz białkowych aktywowanych mitogenami (MAPK) oraz (tylko dla CB 1 ) modulację kanałów wapniowych i potasowych. Co więcej, w działaniu receptorów CB1 mogą pośredniczyć białka Gq i Gs , niezależnie od białek G. Receptory CB 1 zlokalizowane są głównie w ośrodkowym układzie nerwowym, natomiast receptory CB 2 występują obficie w układzie odpornościowym. Zatem kannabinoidy mogą wywierać ważne prohomeostatyczne funkcje fizjologiczne poprzez modulowanie uwalniania neuroprzekaźników i odpowiedzi immunologicznych. Warto zauważyć, że wykazano obecność obu typów receptorów w całym organizmie, a ich ekspresja może zmieniać się w stanach patologicznych [ 17 , 22 , 27 ].
Kannabidiol ma niskie powinowactwo do receptorów kannabinoidowych (w stężeniach mikromolowych) [ 22 ]. Nie wywołuje efektów typowych dla stymulacji ośrodkowych receptorów CB 1 , takich jak hipoalgezja, hipotermia, katalepsja i obniżona aktywność motoryczna (tzw. tetrada kannabinoidowa), charakterystycznych dla THC [ 18 ]. Co więcej, CBD jest zdolne do antagonizowania działania agonistów receptora CB 1 /CB 2 (CP55940 i R-(+)-WIN55212) już przy stężeniach nanomolowych, a więc niższych niż wynikające z jego powinowactwa do tych receptorów [ 26 ]. Wykazano, że CBD jest odwrotnym agonistą receptora CB 2 [ 26 ] i negatywnym modulatorem allosterycznym receptorów CB 1 [ 12 ]. Pomimo braku agonistycznych właściwości receptorów CB 1 /CB 2 przez CBD, niektóre jego efekty są hamowane przez antagonistów/odwrotnych agonistów tych receptorów [ 8 , 45 ] lub nie są obecne u myszy z nokautem CB 1 [ 46 ]. Jest to najprawdopodobniej efekt pośredniego kannabinomimetycznego działania CBD, gdyż wykazano, że jego podawanie zwiększa stężenie endogennych kannabinoidów – anandamidu (AEA) [ 8 , 14 , 15 ] i 2-arachidonoiloglicerolu (2-AG) [ 45 ]. Mechanizmy tego efektu mogą obejmować zmniejszony rozkład i wewnątrzkomórkowy wychwyt endokannabinoidów. CBD hamuje główny enzym odpowiedzialny za rozkład AEA (oraz w mniejszym stopniu 2-AG) [ 27 ] – hydrolazę amidu kwasu tłuszczowego (FAAH) u gryzoni [ 9 , 16 ], ale nie u ludzi [ 10 ]. Co więcej, CBD hamuje wychwyt AEA, działając na domniemany transporter błonowy endokannabinoidów (EMT) [ 9 , 16 ] i/lub konkurując z AEA o wiązanie z białkami wiążącymi kwasy tłuszczowe (FABP-3, -5, -7), które stanowią wewnątrzkomórkowy system transportu endokannabinoidów [ 10 ].
Liczne badania wykazały, że CBD ma wiele efektów niezależnych od bezpośredniej lub pośredniej interakcji z receptorami CB 1 /CB 2 . Agonistyczne działanie CBD wykazano w odniesieniu do: przejściowego potencjalnego receptora, członka podrodziny ankiryn 1 (TRPA1) i członków podrodziny waniloidów 1–4 (TRPV1–4), receptora aktywowanego przez proliferatory peroksysomów γ (PPARγ), sierocego białka G receptor sprzężony – GPR18 (CBD jest częściowym agonistą, ale antagonizuje działanie THC) oraz receptory serotoninowe 5-HT 1A i 5-HT 2A (częściowy agonista). Ponadto CBD jest dodatnim allosterycznym modulatorem receptorów α1-, α1β- i α3-glicynowych (α1-, α1β- i α3-GlyR), μ- i δ-opioidowych (μ- i δ-OR) oraz γ-aminomasłowego. receptor kwasowy typu A (GABA A ). W przeciwieństwie do tego, CBD wykazuje działanie antagonistyczne w stosunku do receptora sierocego GPR55 (nawet postulowanego jako receptor CB 3 ), domniemanego receptora nieprawidłowego kannabidiolu (Abn-CBD; patrz poniżej) i potencjalnego receptora przejściowego, członka podrodziny melastatyny 8 (TRPM8). Ponadto jest negatywnym allosterycznym modulatorem receptora serotoninowego 5-HT 3 , receptora α 1 -adrenergicznego (α 1 -AR) i receptora dopaminy D 2 [ 11 , 17 , 21 ]. Ostatnio wykazano również, że CBD jest odwrotnym agonistą receptorów sierocych GPR3, GPR6 i GPR12 [ 13 ].
Oprócz bezpośredniej ekspozycji na szereg receptorów, CBD może oddziaływać także poprzez pośrednie zwiększanie stężenia związków biologicznie aktywnych. Oprócz wspomnianego już wpływu na poziom endokannabinoidów, CBD hamuje m.in. wychwyt adenozyny, tymidyny, glutaminianu, serotoniny, kwasu γ-aminomasłowego, dopaminy i noradrenaliny. Poziom serotoniny można także modulować poprzez hamowanie rozkładu jej prekursora, tryptofanu. Dodatkowo CBD wpływa także na metabolizm kwasu arachidonowego poprzez wpływ na fosfolipazę A2 ( PLA 2 ; stymulacja lub hamowanie w zależności od stężenia CBD), 5- i 15-lipooksygenazę (5-, 15-LOX; hamowanie) czy izoenzymy cyklooksygenazy (COX -1 i -2; hamowanie lub stymulacja). W konsekwencji wykazano zarówno zmniejszoną, jak i zwiększoną produkcję prostaglandyny E (PGE) [ 11 , 17 , 21 ]. Biorąc pod uwagę ścisłe powiązanie szlaków metabolicznych kwasu arachidonowego i endokannabinoidów (wspólne enzymy metaboliczne; kwas arachidonowy powstaje w wyniku rozkładu endokannabinoidów) [ 27 ], CBD może kompleksowo wpływać na powstawanie dużej grupy mediatorów – pochodnych kwasu arachidonowego i endokannabinoidów.
Podsumowując, CBD ma złożony profil farmakodynamiczny (Rysunek 2). Jednak w wielu przypadkach jego działanie występuje już przy bardzo wysokich stężeniach i dotychczas jedynie in vitro. Niemniej jednak tak złożony mechanizm działania może wyjaśniać szeroki potencjał terapeutyczny CBD.
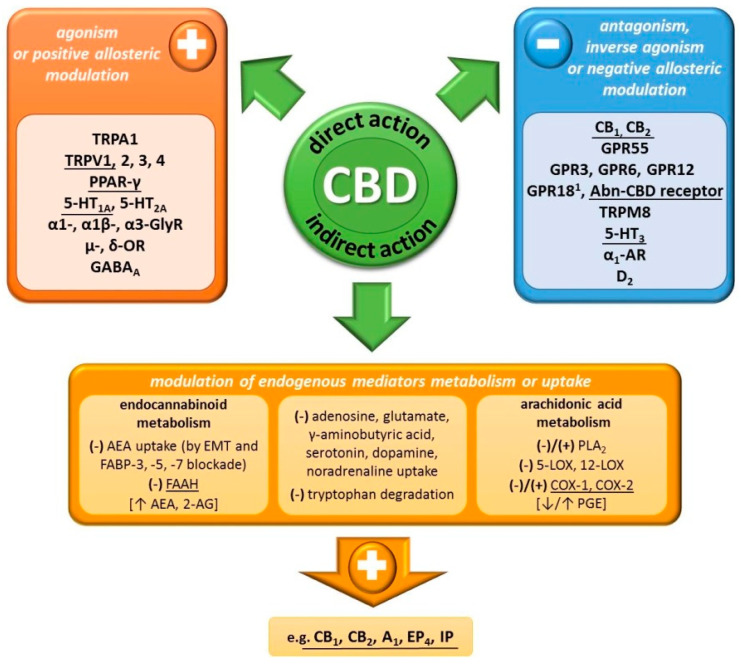
Rysunek 2
Mechanizm działania kanabidiolu (CBD) [ 8 , 9 , 10 , 11 , 12 , 13 , 14 , 15 , 16 , 17 , 21 , 22, 26 , 27 , 45 , 46 ] . Podkreślono mechanizmy, poprzez które CBD oddziałuje na układ sercowo-naczyniowy [ 23 , 30 , 47 , 48 , 49 , 50 , 51 , 52 , 53 , 54 , 55 , 56 , 57 ] . 1 CBD jest częściowym agonistą GPR18 o niskiej skuteczności i antagonizuje działanie THC (CBD działa jako antagonista); skróty: 5-, 12-LOX: 5-,12-lipoksygenaza; 2-AG: 2-arachidonoiloglicerol; 5-HT 1A, 2A, 3 : Receptory serotoninowe typu 1A, 2A, 3; Abn-CBD: nieprawidłowy kannabidiol; AEA: Anandamid; A1 : Receptor adenozynowy typu 1; CB 1, 2 : Receptor kannabinoidowy typu 1, 2; COX-1,-2: Cyklooksygenaza 1, 2; D2 : Receptor dopaminy typu 2; EMT: transporter błonowy endokannabinoidów; EP 4 : Receptor prostaglandyny E 4; FAAH: hydrolaza amidu kwasu tłuszczowego; FABP-3,-5,-7: białko wiążące kwasy tłuszczowe 3, 5, 7; GABA A : receptor kwasu γ-aminomasłowego typu A; GPR3, 6, 12, 18, 55: receptor 3, 6, 12, 18, 55 sprzężony z białkiem G; IP: receptor prostacykliny; PGE: prostaglandyna E; PPAR-γ: receptor γ aktywowany przez proliferatory peroksysomów; TRPA1: Przejściowy potencjał receptora, członek podrodziny ankyryn 1; TRPM8: Przejściowy potencjał receptora, członek podrodziny melastatyny 8; TRPV1-4: Członkowie 1-4 podrodziny waniloidów o potencjale przejściowym; α1-, α1β-, α3-GlyR: receptor α1, α1β-, α3-glicyny; α1 – AR: α1 – receptor adrenergiczny; δ-, μ-OR: δ-, μ-Receptor opioidowy.
2.3. Farmakokinetyka
Istnieją różne drogi podawania kannabidiolu, z czego najczęstszą jest droga inhalacyjna (palenie, waporyzacja lub nebulizacja) i doustna (oleje, kapsułki, żywność i napoje wzbogacone w CBD). W zastosowaniach terapeutycznych można go także podawać w postaci sprayu na błonę śluzową jamy ustnej (Sativex ® ). Można go także podawać dożylnie, przezskórnie, doodbytniczo lub w postaci kropli do oczu [ 4 , 30 , 33 ]. Biodostępność jest zróżnicowana w zależności od drogi podania, np. dla drogi inhalacyjnej szacuje się ją na 31%, a maksymalne stężenie osiągane jest po 3–10 minutach od spożycia. Natomiast przy podaniu doustnym maksymalne stężenia osiągane są po 1–2 lub do sześciu godzinach od spożycia, a biodostępność wynosi poniżej 20%, ze względu na metabolizm pierwszego przejścia [ 4 , 58 ].
Niektórzy autorzy sugerują, że podanie doustne wiąże się z możliwą przemianą CBD w THC w kwaśnym środowisku żołądka (Rysunek 3). Taką konwersję stwierdzono w badaniach z symulowanym płynem żołądkowym [ 59 , 60 ]. Wydaje się jednak, że konwersja ta nie zachodzi in vivo u ludzi, o czym świadczy brak THC we krwi pacjentów, którzy przyjmowali doustnie nawet bardzo duże dawki CBD. Ponadto związek ten nie powoduje żadnych efektów psychologicznych, psychomotorycznych, poznawczych czy fizjologicznych typowych dla THC czy marihuany. Rozbieżność tę można wytłumaczyć faktem, że soki żołądkowe nie odzwierciedlają doskonale rzeczywistych warunków panujących w żołądku [ 61 , 62 ]. Badania na zwierzętach również wykazują sprzeczne dane. Hložek i in. [ 63 ] wykazali obecność THC we krwi szczurów po doustnym (a także podskórnym) podaniu CBD. Jednakże Palazzoli i in. [ 64 ] nie donieśli o braku THC we krwi szczurów, którym podano doustnie pojedynczą wysoką dawkę CBD po trzech i sześciu godzinach od podania. Podobnie nie stwierdzono THC u świnek morskich otrzymujących doustnie CBD przez pięć dni [ 65 ]. Zatem możliwa konwersja CBD na THC wydaje się wątpliwa.
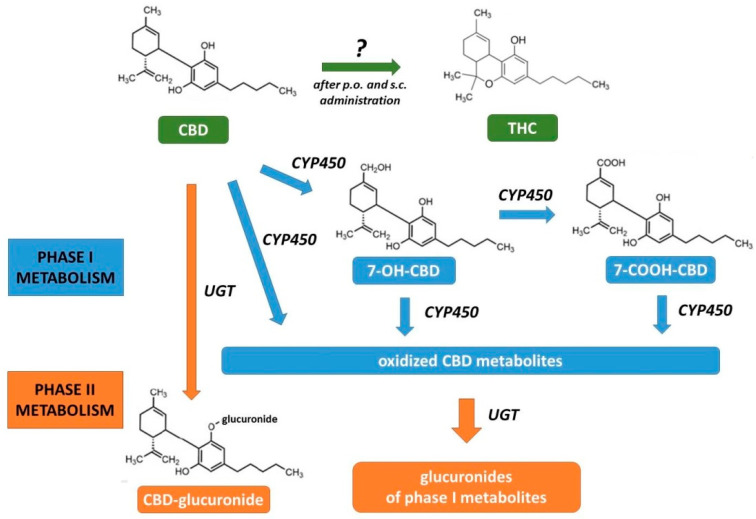
Rysunek 3
Metabolizm kanabidiolu [ 59 , 60 , 61 , 62 , 63 , 64 , 65 , 67 , 68 ]. Skróty: 7-COOH-, 7-OH-CBD:7-karboksy-, 7-hydroksykannabidiol; CBD: kanabidiol; CYP: Cytochrom P450; po: Per os, ustnie; sc: podskórnie; THC: Δ 9 -Tetrahydrokannabinol; UGT: UDP-glukuronozylotransferaza.
Kannabidiol transportowany jest we krwi głównie w formie związanej z białkami, a około 10% CBD wiąże się z erytrocytami. Szybko ulega dystrybucji do wszystkich narządów dobrze ukrwionych, takich jak mózg, serce, płuca i wątroba. Objętość dystrybucji CBD wynosi około 32 l/kg. Ze względu na dużą lipofilowość może przy długotrwałym stosowaniu gromadzić się w tkance tłuszczowej [ 4 , 66 ].
Kannabidiol jest eliminowany poprzez metabolizm i wydalanie. CBD jest wydalane zarówno w stanie niezmienionym, jak i w postaci metabolitów z moczem i kałem [ 4 , 67 ]. Podawany okres półtrwania CBD u ludzi zależy od badania (różne dawki, drogi podawania) i może wahać się od około jednej godziny do pięciu dni [ 58 , 67 ]. Kannabidiol ulega biotransformacji składającej się z dwóch faz (Rysunek 3). Pierwsza zachodzi głównie w wątrobie, gdzie CBD ulega przemianom z udziałem izoenzymów cytochromu P450 (CYP). W badaniu z udziałem ludzkiego rekombinowanego CYP wykazano, że CYP1A1, CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4 i CYP3A5 mogą metabolizować CBD, z czego CYP3A4 i CYP2C19 odgrywają dominującą rolę w mikrosomach wątroby [68 ] . Profile metaboliczne CBD różnią się w zależności od gatunku. U ludzi zidentyfikowano około 40 różnych metabolitów fazy I, a głównymi z nich są pochodne 7-karboksykannabidiolu (7-COOH-CBD). Aktywność farmakologiczna metabolitów fazy I jest różna, np. 7-hydroksy-kannabidiol (7-OH-CBD), podobnie jak CBD, hamuje wychwyt FAAH i AEA, podczas gdy 7-COOH-CBD nie wykazuje takiej aktywności; zarówno 7-OH-CBD, jak i 7-COOH-CBD nie są agonistami TRPV1. Zarówno CBD, jak i jego utlenione metabolity fazy I ulegają glukuronidacji, która jest główną reakcją fazy II [ 67 ].
Warto zaznaczyć, że CBD jest nie tylko substratem dla izoenzymów CYP, ale może również wpływać na ich aktywność. Wykazano, że CBD jest inhibitorem CYP1A1, CYP1A2, CYP1B1, CYP2C19, CYP2C9, CYP2D6, CYP3A4, CYP3A5 i CYP3A7 [ 11 ]. Z drugiej strony dłuższe przyjmowanie CBD może indukować ekspresję niektórych izoenzymów, co wykazano u myszy dla CYP3A i CYP2B10. CBD indukowało także ekspresję CYP1A1 w ludzkich komórkach wątroby. Zatem wpływ na aktywność/ekspresję izoenzymów CYP skutkuje możliwością interakcji CBD z innymi jednocześnie stosowanymi lekami [ 67 , 69 ]. W obszarze leków kardiologicznych opisano dotychczas jeden przypadek takiej interakcji. Jednoczesne stosowanie warfaryny (antykoagulantu) i CBD (Epidiolex ® ) nasilało działanie przeciwzakrzepowe (wzrost międzynarodowego współczynnika znormalizowanego, INR). Jak sugerują autorzy, mogło to wynikać z konkurencji o wiązanie i hamowanie przez CBD izoenzymów CYP zaangażowanych w metabolizm warfaryny [ 70 ]. Dlatego należy zachować ostrożność podczas jednoczesnego stosowania CBD z innymi lekami.
3. Wpływ kannabidiolu na układ sercowo-naczyniowy w warunkach fizjologicznych
Podawanie fito-, endo- i syntetycznych kannabinoidów ma różnorodny, czasem wielofazowy wpływ na ciśnienie krwi (BP) i częstość akcji serca (HR) w zależności od gatunku, drogi podania, obecności znieczulenia i innych warunków doświadczalnych [ 19 ]. Kannabinoidy mogą wpływać na czynność układu krążenia nie tylko poprzez receptory kannabinoidowe, ale szereg innych receptorów, zlokalizowanych zarówno w układzie nerwowym, jak i bezpośrednio w naczyniach krwionośnych i sercu [ 19 , 35 , 71 , 72 ]. Pobudzenie ośrodkowych receptorów CB 1 powoduje wzrost ciśnienia krwi, natomiast obwodowe receptory CB 1 zlokalizowane presynaptycznie na zakończeniach przed- i/lub zazwojowych neuronów współczulnych unerwiających serce i opór naczyniowy odpowiadają za hipotensyjne działanie kannabinoidów. Aktywacja receptorów CB 1 znajdujących się w mięśniu sercowym zmniejsza kurczliwość. Ponadto kannabinoidy mogą stymulować lub hamować odruch Bezolda-Jarischa, charakteryzujący się krótką i silną bradykardią oraz niedociśnieniem, za pośrednictwem receptorów TRPV1 i 5-HT3 zlokalizowanych na czuciowych włóknach nerwu błędnego [ 19 , 72 ]. Kannabinoidy w większości przypadków powodują rozszerzenie naczyń w izolowanych naczyniach krwionośnych lub perfundowanych łożyskach naczyniowych, chociaż obserwuje się również zwężenie naczyń. Efekty te wynikają z bezpośredniej aktywacji CB1 , TRPV1, PPAR i domniemanych śródbłonkowych receptorów kannabinoidowych. Ponadto w niektórych badaniach wykazano rolę receptorów CB 2 , GPR55 i 5-HT 1A w wazoaktywnym działaniu kannabinoidów [ 71 , 72 ]. Kannabinoidy mogą również aktywować sierocy GPR18 zlokalizowany obwodowo w naczyniach krwionośnych (GPR18 został przez niektórych autorów zdeorfanizowany jako śródbłonkowy receptor kannabinoidowy, patrz poniżej) i centralnie w rdzeniu brzuszno-bocznym przednim (RVLM), co powoduje rozluźnienie naczyń i niedociśnienie [ 35 , 73 ]. Kannabinoidy mogą również oddziaływać na układ sercowo-naczyniowy poprzez swoje metabolity, np. prostanoidy. Zatem rozluźnienie naczyń lub zwężenie naczyń wywołane przez kannabinoidy odbywało się pośrednio poprzez receptor prostaglandyny E 4 (EP 4 ) i receptor prostacykliny (IP) lub receptor prostaglandyny E 1 (EP 1 ) i receptor tromboksanu (TP), odpowiednio [ 19 , 71 ].
Poszukiwanie odpowiednich badań oceniających wpływ CBD na układ sercowo-naczyniowy w warunkach fizjologicznych przeprowadzono poprzez elektroniczne przeszukiwanie trzech baz danych (PubMed, Cochrane Library i EBSCO) od ich powstania do marca 2020 r. Słowa kluczowe wyszukiwania obejmowały: kannabidiol i układ sercowo-naczyniowy, hemodynamiczny, krew ciśnienie, tętno, przepływ krwi, naczynia krwionośne, serce, rozszerzenie naczyń lub działanie zwiotczające naczynia krwionośne. Ręcznie przeszukano także referencje z uwzględnionych badań.
Złożony mechanizm działania kannabidiolu pozwala na wielokierunkowe działanie na układ sercowo-naczyniowy. Jednakże dotychczasowe badania na zwierzętach i ludziach w dużej mierze wskazują na brak lub niewielki wpływ CBD podawanego doustnie (po), dożylnie (iv), dotętniczo, dootrzewnowo (ip), ośrodkowo lub poprzez inhalację (po ostrych i powtarzających się dawkowanie) na skurczowe (SBP), rozkurczowe (DBP) lub średnie (MBP) ciśnienie tętnicze krwi i/lub częstość akcji serca w warunkach fizjologicznych (Tabela 2) [ 7 , 15 , 49 , 55 , 74 , 75 , 76 , 77 , 78 , 79 , 80 , 81 , 82 , 83 , 84 , 85 , 86 , 87 , 88 , 89 , 90 , 91 , 92 , 93 , 94 , 95 , 96 , 97 ]. Potwierdzają to wyniki metaanalizy Sultana i wsp. [ 24 ], co wykazało brak wpływu CBD na HR i BP zarówno po podaniu ostrym, jak i przewlekłym (w tym drugim przypadku analizowano jedynie HR). Jednakże, jest kilka wyjątków. U ludzi CBD nieznacznie wzrosło (przy dawce 40 mg, ale nie 20 mg, podanej podjęzykowo) [ 98 ] lub obniżyło spoczynkowe ciśnienie krwi (600 mg, doustnie) po ostrym dawkowaniu [ 97 , 99 ], ale nie po wielokrotnym dawkowaniu (600 mg przez 7 dni, po) [ 97 ]. Odwrotnie, nie zaobserwowano tolerancji na hipotensyjne działanie CBD po jego przewlekłym doustnym dawkowaniu wzrastającym ze 100 do 600 mg/dzień przez 6 tygodni u pacjentów z dystonicznymi zaburzeniami ruchu [ 100 ]. Wykazano również, że CBD może zwiększać regionalny mózgowy przepływ krwi (CBF) [ 101 ]. Wpływ CBD na układ sercowo-naczyniowy u człowieka może zależeć nie tylko od dawki [ 98 ] i czasu podawania [ 97 ], ale także od sposobu dostarczania CBD. Zatem doustne CBD w dawce 90 mg nie miało wpływu na BP, HR i CBF, jednak ta sama dawka CBD kapsułkowana co TurboCBD TM (opatentowany preparat w kapsułkach zwiększających biodostępność CBD) zmniejszyła DBP i MBP oraz zwiększyła CBF [ 94 ]. U zwierząt CBD może również w różny sposób wpływać na parametry sercowo-naczyniowe. Zwiększał MBP i HR u psów znieczulonych pentobarbitalem [ 102 ], zmniejszał HR u przytomnych królików [ 103 ], zmniejszał MBP u myszy znieczulanych ketaminą i ksylazyną [ 104 ], nieznacznie podnosił SBP, DBP i HR u przytomnych szczurów [ 52 ] i zmniejszał MBP u szczurów znieczulonych pentobarbitalem [ 104 , 105 ]. U szczurów znieczulonych uretanem CBD podawane dożylnie nie miało wpływu na parametry hemodynamiczne [ 74] Jednakże po szybkim wstrzyknięciu może wywołać odruch Bezolda-Jarischa poprzez receptory TRPV1. Dodatkowo CBD osłabiło odruch Bezolda-Jarischa wywołany aktywacją receptora 5-HT 3 [ 52 ]. CBD może również modyfikować odpowiedź baroreceptorową po podaniu centralnym (do jądra łożyska prążka końcowego, BNST). Zatem wykazywał korzystny wpływ na odruchową reakcję bradykardyczną na wzrost ciśnienia krwi poprzez aktywację receptorów 5-HT 1A [ 47 ]. Po rdzeniu i wagotomii u szczurów znieczulonych uretanem, czyli po zniesieniu odruchów i wpływie ośrodkowego układu nerwowego na układ sercowo-naczyniowy, CBD spowodowało wzrost HR i ciśnienia skurczowego, natomiast spadek ciśnienia rozkurczowego prawdopodobnie wynikał z rozszerzenia naczyń [ 52 ]
Tabela 2
Wpływ kannabidiolu (CBD) in vivo na układ sercowo-naczyniowy w warunkach fizjologicznych 1 .
| Gatunek | Znieczulenie | Trasa | Dawka | Efekty 2 | Bibliografia |
|---|---|---|---|---|---|
| Pojedyncza administracja | |||||
| człowiek | – | po | 320 µg/kg | ↔ HR | [ 75 ] |
| człowiek | – | po | 1 mg/kg | ↔ HR | [ 77 ] |
| człowiek | – | po | 100; 600; 1200mg | ↔ DBP, SBP, HR | [ 78 ] |
| człowiek | – | po | 300 mg | ↔ SBP, HR | [ 80 ] |
| człowiek | – | po | 400 mg | ↑ CBF (regionalne) | [ 101 ] |
| człowiek 3 | – | śl | 20; 40 mg | ↑ SBP ↔ DBP, HR | [ 98 ] |
| człowiek | – | po | 600 mg | ↔ SBP, DBP, HR | [ 83 ] |
| człowiek | – | po | 600 mg | ↔ BP, HR | [ 84 ] |
| człowiek | – | po | 600 mg | ↔ BP, HR | [ 85 ] |
| człowiek | – | po | 600 mg | ↔ BP, HR | [ 86 ] |
| człowiek | – | po | 600 mg | ↔ DBP, SBP, HR | [ 88 ] |
| człowiek | – | po | 600 mg | ↔ BP, HR | [ 89 ] |
| człowiek | – | po | 600 mg | ↔ DBP, SBP, HR | [ 91 ] |
| człowiek | – | po | 200; 400; 800 mg | ↔ DBP, SBP, HR | [ 93 ] |
| człowiek | – | po | 600 mg | ↓ SBP, DBP, MBP, SV, TPR, SBF ↑ HR ↔ CO, EJT | [ 99 ] |
| człowiek | – | po | 45; 90 mg | ↔ SBP, DBP, MBP, HR, CBF | [ 94 ] |
| 45; 90 mg TurboCBDTM 4 | ↔ SBP, HR ↓ DBP, MBP ↑ CBF | ||||
| człowiek | inhalacja (parowanie) | 400 mg | ↔ HR, SBP, DBP (↑ DBP u osób często używających konopi indyjskich) | [ 7 ] | |
| człowiek 5 | – | wdychanie (palenie) | 1/2 papierosa zawierająca ~800 mg konopi indyjskich (0,4% THC/10,4% CBD) | ↔ SBP, DBP, HR | [ 95 ] |
| człowiek | – | po | 600 mg | ↓ MBP ↔ SBP, DBP, HR, CO, SV, EJT, TPR | [ 97 ] |
| pies | pentobarbital | IV | 0,5; 1 mg/kg | ↑ MBP, HR | [ 102 ] |
| Królik | – | IV | 25 mg/kg | ↓ HR | [ 103 ] |
| szczur | – | ip | 10 mg/kg | ↔ MBP, HR | [ 82 ] |
| szczur | – | ip | 1; 10; 20 mg/kg | ↔ MBP, HR | [ 55 ] |
| szczur | – | ip | 10 mg/kg | ↑ (nieznaczne) SBP, DBP, HR | [ 52 ] |
| szczur | uretan | IV | 1 mg/kg | ↔ BP, HR | [ 74 ] |
| szczur | uretan | iv (szybkie) | 3; 10; 30 mg/kg | ↓ SBP, DBP, HR (odruch Bezolda-Jarischa indukowany przez TRPV1) ↓ Odruch Bezolda-Jarischa indukowany przez aktywację 5-HT3 ( ale nie TRPV1) | [ 55 ] |
| szczur 6 | uretan | IV | 1; 3; 30 mg/kg | ↑ SBP, HR ↓ DBP | [ 55 ] |
| szczur | pentobarbital | ia lub iv | 1-2000 µg | ↔ MBP | [ 81 ] |
| szczur | pentobarbital | IV | 10; 50 µg/kg | ↓ MBP ↔ HR | [ 105 ] |
| szczur | pentobarbital | IV | 50 µg/kg | ↓ MBP ↔ HR | [ 104 ] |
| szczur | tiopental | IV | 50 µg/kg | ↔ MBP, HR | [ 49 ] |
| szczur | – | ic | 15; 30; 60 nmoli | ↔ MBP, HR | [ 87 ] |
| szczur | – | do BNST | 15; 30; 60 nmoli | ↔ MBP, HR | [ 90 ] |
| szczur | – | do BNST | 15; 30; 60 nmoli | ↔ MBP, HR | [ 92 ] |
| szczur | – | do BNST | 60 nmoli | ↔ MBP, HR ↑ odruchowa reakcja bradykardiczna na wzrost BP (efekt zależny od 5-HT 1A ) ↔ odruchowa reakcja tachykardiologiczna na spadek BP | [ 47 ] |
| mysz | ketamina + ksylazyna | IV | 50 µg/kg | ↓ MBP ↔ HR | [ 104 ] |
| Przewlekłe podawanie | |||||
| człowiek | – | po | 3 mg/kg przez 30 dni | ↔ HR, EKG | [ 76 ] |
| człowiek 7 | – | po | 200-300 mg przez 4,5 miesiąca | ↔ HR, EKG | [ 76 ] |
| człowiek | – | po | 1200 mg przez 20 dni | ↔ DBP, SBP, HR | [ 78 ] |
| człowiek 8 | – | po | zwiększając dawki 100-600 mg przez 6 tygodni | ↓ BP | [ 100 ] |
| człowiek 9 | – | po | 10 mg/kg/dzień przez 6 tygodni | ↔ MBP, HR | [ 79 ] |
| człowiek 10 | – | po | 800 11 mg przez 4 tygodnie | ↔ SBP, DBP, HR | [ 15 ] |
| człowiek | – | po | 600 mg przez 7 dni | ↔ SBP, DBP, MBP, HR ↑ PWV, FMD | [ 97 ] |
| szczur | – | ip | 10 mg/kg przez 14 dni | ↔ SBP, DBP, HR 11,12 ↑ markery stresu oksydacyjnego w osoczu (MDA 11 , 4-HHE 11,12 , 4-HNE 11 ) i sercu (MDA 11 , 4-HHE 11 , 4-HNE 11 ) | [ 9 |
1 dotyczy wyłącznie układu sercowo-naczyniowego; 2 efekty zaobserwowane przy co najmniej jednej z badanych dawek; 3 pacjentów z jaskrą; 4 TurboCBD TM to opatentowany preparat w kapsułkach CBD zwiększający jego biodostępność (45 lub 90 mg CBD, 600 mg żeń-szenia amerykańskiego, 240 mg miłorzębu japońskiego , 150 mg organicznego oleju konopnego); 5 pacjentów z zaburzeniami obsesyjno-kompulsyjnymi; Szczur 6- rdzeniowy i z wagotomią; 7 pacjentów chorych na padaczkę; 8 pacjentów z dystonicznymi zaburzeniami ruchu; 9 pacjentów z chorobą Huntingtona; 10 pacjentów chorych na schizofrenię; 11 leczenie rozpoczynało się od dawki 200 mg/dobę i zwiększano ją stopniowo o 200 mg/dobę do dawki dobowej 800 mg/dobę (200 mg cztery razy na dobę) w ciągu pierwszego tygodnia (u niektórych pacjentów dawkę zmniejszono do 600 mg/dobę po dwa tygodnie ze względu na skutki uboczne); 11 szczurów kontrolnych z normotensją dla SHR (szczury Wistar-Kyoto); 12 szczurów kontrolnych z normotensją i szczurami z solą DOCA; ↑/↓/↔ — wzrost/spadek/brak zmian; skróty: 4-HHE: 4-Hydroksyheksenal; 4-HNE: 4-hydroksynonenal; 5-HT 1A,3 : Receptory serotoninowe typu 1A, 3; BNST: jądro łoża prążkowia końcowego; BP: ciśnienie krwi; CO: pojemność minutowa serca; DBP: rozkurczowe ciśnienie krwi; EKG: elektrokardiogram; EJT: czas wyrzutu lewej komory; FMD: dylatacja za pośrednictwem przepływu; HR: tętno; m.in.: dotętniczo; ic: Wewnątrzoponowo; ip: dootrzewnowo; iv: Dożylnie; MBP: Średnie ciśnienie krwi; MDA: dialdehyd malonowy; po: Per os, ustnie; PWV: prędkość fali pulsacyjnej; sl: podjęzykowo; SBF: przepływ krwi w skórze przedramienia; SBP: skurczowe ciśnienie krwi; SV: objętość skurczowa; THC –Δ 9 –Tetrahydrokannabinol; TPR: całkowity opór obwodowy; TRPV1: członek podrodziny waniloidów o potencjale przejściowym, receptor 4.
Wykazano działanie rozszerzające naczynia krwionośne CBD na izolowane naczynia ludzkie i zwierzęce, zarówno w warunkach fizjologicznych (Tabela 3) [ 48 , 56 , 106 ] oraz stany patologiczne (patrz niżej) i jest to prawdopodobnie najbardziej spójne działanie tego związku na układ sercowo-naczyniowy. Mechanizm działania CBD na naczynia jest złożony i zależy od badanego łożyska naczyniowego, nie obejmuje jednak receptorów kannabinoidowych [ 48 , 106 ], z wyjątkiem izolowanych ludzkich tętnic krezkowych, gdzie wykazano zależność od receptorów CB 1 [ 56 ] . Warto zauważyć, że CBD powoduje zależne od czasu rozszerzenie naczyń poprzez receptory jądrowe PPAR-γ [ 48 , 56 , 106 ]. Niemniej jednak działanie rozszerzające naczynia krwionośne CBD ex vivo w większości przypadków nie przekłada się na ogólnoustrojowe ciśnienie krwi (brak spadku ciśnienia krwi po podaniu CBD, patrz wyżej). Eksperymenty na szczurach z rdzeniem i wagotomią, u których CBD zmniejszyło DBP, wykazały, że działanie wazorelaksacyjne CBD in vivo może być maskowane przez napięcie neurogenne [ 52 ]. Badania na ludzkich komórkach śródbłonka aorty (Tabela 3) wykazało, że CBD zmniejszyło fosforylację N-końcowej kinazy c-Jun (JNK), czynnika jądrowego κB (NF-κB), rybosomalnej kinazy białkowej S6 (p70S6K) oraz przetwornika sygnału i aktywatora transkrypcji 5 (STAT5) oraz zwiększoną fosforylację Element odpowiedzi cAMP – białko wiążące (CREB), sygnał zewnątrzkomórkowy – kinaza regulowana 1/2 ( ERK1/2), kinaza białkowa B (Akt) i śródbłonkowa syntaza tlenku azotu (NOS). Te zmiany w fosforylacji białek wewnątrzkomórkowych mogą wyjaśniać właściwości CBD rozszerzające naczynia (ERK, Akt i śródbłonkowy NOS), antyangiogenne (p70S6K i STAT5) i przeciwzapalne (JNK i NF-κB) [56 ] . Kannabidiol wywiera także pozytywny wpływ na komórki mięśni gładkich naczyń (Tabela 3), których nieprawidłowa proliferacja i migracja są powiązane z rozwojem i postępem nowotworów i chorób układu krążenia. Zatem CBD hamowało proliferację i migrację komórek mięśni gładkich ludzkiej tętnicy pępowinowej oraz zwiększało aktywność enzymu cytoprotekcyjnego, oksygenazy hemowej-1. Temu ostatniemu efektowi towarzyszyła indukowana przez CBD produkcja reaktywnych form tlenu [ 107 ]. Jest to zaskakująca obserwacja, biorąc pod uwagę wiele badań wykazujących właściwości przeciwutleniające CBD [ 31 ]. Jednakże w innym badaniu CBD po podaniu chronicznie obniżyło markery stresu oksydacyjnego u szczurów z nadciśnieniem, ale wykazywało działanie prooksydacyjne u zwierząt kontrolnych z normotensją, szczególnie u szczurów Wistar-Kyoto (Tabela 2) [ 96 ].
Tabela 3
Wpływ kannabidiolu (CBD) in vitro i ex vivo na układ sercowo-naczyniowy w warunkach fizjologicznych 1 .
| Gatunek | Narządy/komórki | Stężenie | Efekty 2 | Bibliografia |
|---|---|---|---|---|
| Człowiek 3 | Izolowane tętnice krezkowe (wstępnie zwężone U46619 4 i endoteliną-1) | 0,1–100 μmol/l | -Rozszerzanie naczyń (efekt zależny od CB 1 , TRP, śródbłonka i NO; niezależny od CB 2 , receptora Abn-CBD, COX i kanałów potasowych) | [ 56 ] |
| 10 μmol/L (efekt zależny od czasu) | -Rozszerzenie naczyń (efekt jest niezależny od PPAR-γ) | |||
| Człowiek 5 | Izolowane tętnice płucne (wstępnie zwężone za pomocą U46619 4 ) | 0,1–30 μmol/l | -Rozszerzenie naczyń (efekt zależny od śródbłonka, COX, EP 4 , IP, TRPV1; niezależny od CB 1 i CB 2 ) | [ 48 ] |
| 10 μmol/L (efekt zależny od czasu) | -Rozszerzenie naczyń (efekt zależy od PPAR-γ) | |||
| Człowiek | Ludzkie komórki śródbłonka aorty (HAEC) | 0,1–30 μmol/l | -↓ fosforylacja JNK, NF-κB, p70S6K i STAT5;-↑ fosforylacja CREB, ERK1/2 (efekt zależny od CB 1 i TRPV 1 ), Akt (efekt zależny od CB 1 ) i śródbłonka NOS (efekt zależny od CB 1 ) | [ 56 ] |
| Człowiek | Komórki mięśni gładkich ludzkiej tętnicy pępowinowej (HUASMC) | 0,1–10 μmol/l | -↑ ekspresja HO-1 (efekt zależny od ROS; niezależny od CB 1 , CB 2 , GPR55, TRPV1);-↓ migracja (efekt jest niezależny od HO-1);-↓ proliferacja (efekt jest niezależny od HO-1, ROS, CB 1 , CB 2 , GPR55, TRPV1);-↑ ROZ | [ 107 ] |
| Szczur | Izolowana aorta (wstępnie zwężona U46619 4 i metoksaminą 6 ) | 10 μmol/L (efekt zależny od czasu) | -Rozszerzanie naczyń (efekt zależny od PPAR-γ i SOD, efekt niezależny od śródbłonka, NO, CB 1 , CB 2 , TRPV1) | [ 106 ] |
| Szczur | Izolowane małe tętnice krezkowe (wstępnie zwężone fenylefryną 6 ) | 0,1–30 μmol/l | -Rozszerzenie naczyń (efekt jest niezależny od CB 1 , CB 2 , śródbłonka, TRPV1) | [ 48 ] |
| Szczur | Izolowane perfundowane serce | 30 μmol/l | -↓ HR, kurczliwość;-arytmia i asystolia | [ 108 ] |
| Szczur | Izolowane perfundowane serce | 9–100 μmol/l | -↑ (nieznaczne) HR, ciśnienie tętna, przepływ wieńcowy | [ 110 ] |
| Szczur | Izolowany lewy przedsionek | 0,001–30 μmol/l | -↓ kurczliwość | [ 52 ] |
| Szczur | Izolowane kardiomiocyty komorowe | 0,01–10 μmol/l | -↓ kurczliwość | [ 109 ] |
1 dotyczy wyłącznie układu sercowo-naczyniowego; 2 efekty zaobserwowane przy co najmniej jednym z badanych stężeń; 3 pacjentów z nowotworem lub chorobą zapalną jelit; 4 agonista receptora tromboksanu; 5 pacjentów z rakiem płuc; agonista receptora 6α1 – adrenergicznego ; ↑/↓/↔ — wzrost/spadek/brak zmian; skróty: skróty: Abn-CBD: Abnormal-kannabidiol; AEA: Anandamid; Akt: Kinaza białkowa B; CB 1, 2 : Receptor kannabinoidowy typu 1, 2; COX: cyklooksygenaza; CREB: białko wiążące element odpowiedzi cAMP; EP 4 : Receptor prostaglandyny E 4; ERK1/2: kinaza regulowana sygnałem zewnątrzkomórkowym 1/2; GPR55: receptor 55 sprzężony z białkiem G; HO-1: oksygenaza hemowa-1; HR: tętno; IP: receptor prostacykliny; JNK: N-końcowa kinaza c-Jun; NF-KB: Czynnik jądrowy κB; BNO: Tlenek azotu i jego syntaza; PGE: prostaglandyna E; PPAR-γ: receptor γ aktywowany przez proliferatory peroksysomów; p70S6K: rybosomalna kinaza białkowa S6; ROS: reaktywne formy tlenu; SOD: dysmutaza ponadtlenkowa; STAT5: przetwornik sygnału i aktywator transkrypcji 5; TRP: potencjał receptora przejściowego; TRPV1: Przejściowy potencjał receptora, członek podrodziny waniloidów 1
Badania na izolowanych sercach, przedsionkach lub pojedynczych kardiomiocytach (Tabela 3) wskazują na bezpośrednie ujemne działanie inotropowe kanabidiolu [ 52 , 108 , 109 ]. W izolowanych sercach CBD może zmniejszać [ 108 ] lub nieznacznie zwiększać [ 110 ] częstość akcji serca, a także może mieć działanie proarytmiczne [ 108 ]. Badania na szczurach z rdzeniem i wagotomią wykazały, że CBD może pośrednio wpływać na serce poprzez wywieranie obwodowego efektu sympatykomimetycznego (objawiającego się wzrostem HR i SBP), prawdopodobnie ze względu na wpływ na uwalnianie i/lub wychwyt zwrotny noradrenaliny z układu współczulnego. zaciski [ 52 ]. W niektórych badaniach na ludziach i zwierzętach wykazano także zwiększenie częstości akcji serca (Tabela 2) [ 52 , 99 , 102 ]. Dodatkowo w metaanalizie Sultana i in. [ 24 ] podgrupa szczurów wykazała wzrost HR po podaniu CBD. Jednak w większości przypadków CBD nie wpływa na HR in vivo, co wskazuje (podobnie jak w przypadku naczyń krwionośnych), że efekty peryferyjne mogą być maskowane przez wpływy centralne.
Podsumowując, w warunkach fizjologicznych CBD ma minimalny wpływ na układ sercowo-naczyniowy. Dlatego nie niesie ze sobą zwiększonego ryzyka sercowo-naczyniowego, tak jak THC [ 36 ]. Ponadto CBD może osłabiać niektóre skutki wywołane THC w układzie sercowo-naczyniowym. U królików THC (3 mg/kg) i CBD (25 mg/kg) podane same (iv) obniżyły HR odpowiednio o około 40–50% i 10–20%. Jednakże wstępne leczenie CBD (25 mg/kg) zmniejszyło wielkość i czas trwania bradykardii wywołanej THC [ 103 ]. U ludzi odparowany THC (8 mg) prowadził do zatrucia i tachykardii. Niskie dawki CBD (4 mg) w połączeniu z THC wzmacniały jego działanie odurzające (ale nie wpływały na wzrost HR), podczas gdy wysokie dawki CBD (400 mg) łagodziły zarówno zatrucie wywołane THC, jak i tachykardię [ 7 ]. Zatem proporcje THC i CBD mogą być istotne dla ochronnego wpływu CBD na skutki sercowo-naczyniowe powodowane przez THC. W innym badaniu doustne CBD (200, 400 i 800 mg) nie zmienia subiektywnego, wzmacniającego i sercowo-naczyniowego działania palonej marihuany (1/2 papierosa zawiera ~800 mg konopi; 5,3–5,8% THC) [93 ] . Mieszanka CBD (1 mg/kg) i THC (0,5 mg/kg) (doustnie) nie zapobiegła tachykardii (w przeciwieństwie do lęku i innych efektów przypominających marihuanę) wywołanej przez samo THC podawane (0,5 mg/kg; doustnie) u ludzi [ 77 ] W badaniu klinicznym z THC (5 i 15 mg), niskimi (5,4 mg THC, 5,0 mg CBD) i wysokimi (16,2 mg THC, 15,0 mg CBD) dawkami Sativex ® nie stwierdzono znaczącej modulacji tachykardii i innych fizjologicznych objawów wywołanej przez CBD. zaobserwowano efekty wywołane przez THC [ 111 ]. Z drugiej strony CBD w równomolowych konsternacjach zmniejszyło wywołany THC wzrost HR oraz spadek ciśnienia tętna i przepływu krwi wieńcowej w izolowanych sercach szczurów [ 110 ].
4. Wpływ kannabidiolu na układ sercowo-naczyniowy w stanach patologicznych
Układ endokannabinoidowy nie wydaje się mieć istotnego znaczenia dla regulacji układu krążenia w warunkach fizjologicznych, gdyż zarówno inhibitory FAAH, jak i antagoniści receptora CB 1 nie wpływają znacząco na ciśnienie krwi u zwierząt z prawidłowym ciśnieniem [ 19 , 20 ]. Sytuacja ta zmienia się w stanach patologicznych, gdy często obserwuje się aktywację układu endokannabinoidowego [ 20 , 27 ]. Taka aktywacja może mieć działanie ochronne lub szkodliwe, np. wywołane endokannabinoidami rozluźnienie naczyń jest korzystne w przypadku nadciśnienia tętniczego, ale szkodliwe w przypadku wstrząsu septycznego lub nadciśnienia wrotnego [ 20 , 27 ]. Stany patologiczne mogą również modyfikować działanie podawanych kannabinoidów, np. reakcja depresyjna na THC jest silniejsza u pacjentów z nadciśnieniem niż u pacjentów z prawidłowym ciśnieniem [ 20 ]. Ponadto wpływ kannabinoidów na układ sercowo-naczyniowy można osiągnąć poprzez ich modulujący wpływ na procesy odpornościowe czy równowagę redoks zachodzącą za pośrednictwem receptorów kannabinoidowych i niekannabinoidowych. Kannabinoidy mogą powodować stres oksydacyjny i działanie prozapalne (głównie poprzez receptory CB 1 ), a także działanie antyoksydacyjne i przeciwzapalne (głównie poprzez receptory CB 2 ) [27.31]. Wiadomo, że kannabidiol ma właściwości przeciwutleniające (z pewnymi wyjątkami, patrz wyżej) i przeciwzapalne [ 6 , 30 , 31 , 32 , 33 ]. Zatem może mieć potencjał terapeutyczny w leczeniu różnych chorób układu krążenia, ponieważ stres oksydacyjny i stany zapalne są istotnymi elementami ich patogenezy.
4.1. Zmiany sercowo-naczyniowe wywołane stresem
Kannabidiol może działać jako środek przeciwlękowy w warunkach stresu zarówno w modelach zwierzęcych [ 55,82,87 ] , jak i u ludzi [ 80 ]. Stresujące sytuacje wiążą się ze wzrostem ciśnienia krwi i tętna, natomiast metaanaliza Sultana i wsp. [ 24 ] wykazało, że CBD eliminuje jedno i drugie. Zmniejszenie podwyższonych MBP i HR w szczurzych modelach stresu zaobserwowano po podaniu CBD dootrzewnowo [ 55 , 82 ], jak również centralnie do cisterna magna [ 87 ] lub BNST [ 90 ] (Tabela 4). Co ciekawe, wstrzyknięcie CBD do BNST spowodowało takie skutki jedynie w kontekście strachu uwarunkowanego kontekstowo u szczurów [ 90 ]. W ostrym stresie powstrzymującym CBD podawane do BNST (w tych samych dawkach) nie wpływało na MBP, a nawet nie zwiększało wzrostu HR wywołanego ograniczeniem [ 92 ]. Wykazano, że CBD wpływa na zmiany związane ze stresem w układzie sercowo-naczyniowym poprzez receptory 5-HT 1A [ 55 , 90 , 92 ]. Donoszono o sprzecznych wynikach u ludzi poddawanych różnym rodzajom stresu. Zatem CBD (300 lub 600 mg, doustnie) nie wpływało na ciśnienie krwi i/lub HR zwiększone w wyniku symulowanych wystąpień publicznych [ 80 , 112 ]. I odwrotnie, ostre podanie CBD (600 mg, doustnie) zmniejszyło lub wykazywało tendencję do obniżania ciśnienia krwi (i innych parametrów hemodynamicznych, patrzTabela 4) i zwiększone tętno podczas różnych stresujących warunków, takich jak mentalny test arytmetyczny, izometryczny test ściskania dłoni lub stres zimnem [ 99 ]. W innym badaniu ta sama dawka CBD zarówno po ostrym, jak i przewlekłym leczeniu (przez siedem dni) nieznacznie obniżyła SBP, ale nie miała wpływu na HR (i inne parametry sercowo-naczyniowe, patrzTabela 4) podczas ćwiczenia izometrycznego ściskania dłoni. Zatem tolerancja (obserwowana w warunkach spoczynku, patrz wyżej) na hipotensyjne działanie CBD podczas stresu nie rozwija się. Ponadto wykazano, że wielokrotne dawkowanie CBD zmniejsza sztywność tętnic i poprawia funkcję śródbłonka [ 97 ]. Podsumowując, CBD poza potencjalnym działaniem przeciwlękowym może wykazywać dodatkowo korzystne działanie hemodynamiczne w sytuacjach stresowych. Jednakże te efekty ochronne mogą przynajmniej częściowo wynikać z właściwości przeciwlękowych CBD. Warto zaznaczyć, że stres to prawdopodobnie stan, w którym wpływ CBD na parametry hemodynamiczne jest najbardziej wyraźny.
Tabela 4
Wpływ kannabidiolu (CBD) na zaburzenia sercowo-naczyniowe.
| Gatunek | Model eksperymentalny/warunki | Dawkowanie lub stężenie | Efekty 1 | Bibliografia |
|---|---|---|---|---|
| 1. Zmiany sercowo-naczyniowe wywołane stresem | ||||
| Człowiek | Symulowane wystąpienia publiczne | 300 mg; po | -↔ wzrost SBP wywołany stresem | [ 80 ] |
| Człowiek | Symulowane wystąpienia publiczne u pacjentów z fobią społeczną | 600 mg; po | -↔ wywołany stresem wzrost SBP, DBP, HR | [ 112 ] |
| Człowiek | Stres psychiczny (test arytmetyki mentalnej), stres wysiłkowy (test izometryczny uścisku dłoni) lub stres spowodowany zimnem (test ciśnieniowy zimna) | 600 mg; po | -↓ SBP, DBP, MBP, SV, EJT, TPR, SBF-↑ HR-↔ CO (tuż przed i/lub w trakcie i/lub po teście warunków skrajnych) | [ 99 ] |
| Człowiek | Stres wysiłkowy (izometryczny test uścisku dłoni) | 600 mg; po | -↓ SBP (podczas testu warunków skrajnych), ↔ SBP (tuż przed i po teście warunków skrajnych)-↔ DBP, MBP, HR, CO, SV, EJT, TPR (tuż przed, w trakcie i po teście warunków skrajnych) | [ 97 ] |
| 600 mg; przez 7 dni; po | -↓ SBP (podczas testu warunków skrajnych), ↔ SBP (tuż przed i po teście warunków skrajnych)-↔ DBP, MBP, HR, CO, SV, EJT, TPR (tuż przed, w trakcie i po teście warunków skrajnych)-↓ sztywność tętnic (↓ PWV)-↑ funkcja śródbłonka (↑ FMD) | |||
| Szczur | Strach uwarunkowany kontekstowo | 10 mg/kg; ip | -↓ wywołany stresem wzrost MBP, HR | [ 82 ] |
| Szczur | Ostry stres powstrzymujący | 1; 10; 20 mg/kg; ip | -↓ wywołany stresem wzrost MBP, HR (efekt zależny od 5-HT 1A ) | [ 55 ] |
| Szczur | Ostry stres powstrzymujący | 15; 30; 60 nmoli; ic | -↓ wywołany stresem wzrost MBP, HR | [ 87 ] |
| Szczur | Strach uwarunkowany kontekstowo | 15; 30; 60 nmoli; do BNST | -↓ wywołany stresem wzrost MBP, HR (efekt zależny od 5-HT 1A ) | [ 90 ] |
| Szczur | Ostry stres powstrzymujący | 15; 30; 60 nmoli; do BNST | -↔ wzrost MBP wywołany stresem-↑ wzrost HR wywołany stresem (efekt zależny od 5-HT 1A ) | [ 92 ] |
| 2. Nadciśnienie tętnicze | ||||
| Człowiek | Pacjenci z nadciśnieniem 2 ; izolowane tętnice krezkowe (wstępnie zwężone U46619 3 i endoteliną-1) | 0,1–100 μmol/l | -↔ odpowiedź wazorelaksacyjna | [ 56 ] |
| Człowiek | Pacjenci z nadciśnieniem 4 ; izolowane tętnice płucne (wstępnie zwężone U46619 3 ) | 0,1–30 μmol/l | -↓ odpowiedź wazorelaksacyjna | [ 48 ] |
| Szczur | SHR (model nadciśnienia pierwotnego); świadomy | 10 mg/kg; ip | -↑ SBP, DBP (nieco silniejsze niż przy kontroli normotensyjnej)-↔ HR | [ 52 ] |
| SHR (model nadciśnienia pierwotnego); znieczulony uretanem, z rdzeniem i wagotyzowany | 1; 3; 30 mg/kg; IV | -↑ SBP, HR-↓ DBP (porównywalne z kontrolą normotensyjną) | ||
| SHR (model nadciśnienia pierwotnego); znieczulony uretanem | 3; 10; 30 mg/kg; iv (szybkie) | -↓ SBP, DBP, HR (odruch Bezolda-Jarischa indukowany przez receptory TRPV1; silniejszy niż w kontroli normotensyjnej)-↓ Odruch Bezolda-Jarischa wywołany aktywacją 5-HT3 ( ale nie TRPV1) (porównywalny z kontrolą normotensyjną) | ||
| SHR (model nadciśnienia pierwotnego); izolowany lewy przedsionek | 0,001–30 μmol/l | -↓ kurczliwość (nieco mniejsza niż przy kontroli normotensyjnej) | ||
| Szczur | SHR (model nadciśnienia pierwotnego) | 10 mg/kg; przez 14 dni; ip | -↔ SBP, DBP, HR-↓ markery stresu oksydacyjnego w osoczu (↓ grupy karbonylowe) i w sercu (↓ 4-HHE) | [ 96 ] |
| Sól DOCA (model nadciśnienia wtórnego) | -↔ SBP, HR-↓ markery stresu oksydacyjnego w osoczu i sercu (↓ MDA) | |||
| Szczur | SHR (model nadciśnienia pierwotnego); izolowane małe tętnice krezkowe (wstępnie zwężone fenylefryną) | 0,1–30 μmol/l | -↓ odpowiedź wazorelaksacyjna (rozszerzenie naczyń zależy od śródbłonka CB 1 ; niezależne od śródbłonka, CB 2 , TRPV1) | [ 48 ] |
| sól DOCA (model nadciśnienia wtórnego); izolowane małe tętnice krezkowe (wstępnie zwężone fenylefryną) | -↑ odpowiedź wazorelaksacyjna (rozszerzenie naczyń zależy od śródbłonka, CB 2 i śródbłonka CB 1 ; niezależne od TRPV1) | |||
| 3. Niedokrwienie/zawał mięśnia sercowego, kardiomiopatie, zapalenie mięśnia sercowego | ||||
| Królik | Okluzja LCx (90 min) + reperfuzja (30 h); model niedokrwienia/zawału mięśnia sercowego | 0,1 mg/kg; 10 min przed okluzją i 10 min przed reperfuzją; IV | -↓ troponina I we krwi-↓ dysfunkcja lewej komory (zwiększenie SV, CO, EF, skurczowe pogrubienie ścian)-↑ przepływ krwi w obszarze z ubytkiem perfuzji-↓ wielkość zawału-↓ obrzęk mięśnia sercowego i niedrożność mikronaczyń-↓ naciek neutrofilów w sercu-↓ apoptoza w sercu | [ 116 ] |
| Szczur | Okluzja LAD (30 min) + reperfuzja (7 dni); model niedokrwienia/zawału mięśnia sercowego | 5 mg/kg; przed okluzją, a następnie co 24 godziny przez 7 dni; ip | -↔ frakcja skracająca w badaniu echokardiograficznym-↓ wielkość zawału-↓ naciek leukocytów w sercu-↓ IL-6 w surowicy-↔ CRP, TNF-α w surowicy-↔ HR | [ 115 ] |
| Okluzja LAD w izolowanym sercu (45 min) + reperfuzja (45 min); model niedokrwienia/zawału mięśnia sercowego | 5 mg/kg; 24 godz. i 1 godz. przed izolacją serca; ip | -↔ wielkość zawału-↔ kurczliwość-↔ przepływ wieńcowy | ||
| Szczur | Okluzja LAD (30 min) + reperfuzja (2 godz.); model niedokrwienia/zawału mięśnia sercowego | 10 lub 50 µg/kg; 10 min przed okluzją; IV | -↓ MBP-↔ HR-↓ arytmie-↓ wielkość zawału-↓ agregacja płytek krwi (porównywalna z grupą pozorowaną)-↔ degranulacja komórek tucznych w sercu | [ 105 ] |
| 50 µg/kg; 10 minut przed reperfuzją; IV | -↓ MBP-↔ HR-↔ arytmie-↓ wielkość zawału-↔ agregacja płytek krwi-↔ degranulacja komórek tucznych w sercu | |||
| Szczur | Okluzja LAD (6 min) + reperfuzja (6 min); model niedokrwienia/zawału mięśnia sercowego | 50 µg/kg; 10 min przed okluzją; IV | -↓ arytmie (w zależności od A 1 )-↔ MBP, HR | [ 49 ] |
| Szczur | Kardiomiopatia indukowana doksorubicyną | 5 mg/kg; przez 4 tygodnie; ip | -↓ troponina T i CK-MB w surowicy-↓ zmiany histopatologiczne w sercu-↓ stres oksydacyjny i nitratywny w sercu-↓ zapalenie serca-↓ apoptoza w sercu-↓ Ekspresja NF-κB w sercu-↓ Ca i ↑ Zn i Se w sercu | [ 117 ] |
| Mysz | Kardiomiopatia indukowana doksorubicyną | 10 mg/kg; Przez 5 dni; ip | -↓ CK i LDH w surowicy-↓ dysfunkcja serca-↓ stres oksydacyjny i nitratywny w sercu-↓ upośledzona funkcja mitochondriów serca i biogeneza-↓ aktywacja MMP2 i MMP9 w sercu-↓ śmierć komórek w sercu-↓ zapalenie serca | [ 118 ] |
| Mysz | Eksperymentalne autoimmunologiczne zapalenie mięśnia sercowego | 10 mg/kg; przez 46 dni; ip | -↓ dysfunkcja serca (poprawa funkcji skurczowej i cofnięcie dysfunkcji rozkurczowej oraz sztywność mięśnia sercowego)-↓ zwłóknienie mięśnia sercowego-↓ stres oksydacyjny i nitratywny w sercu-↓ zapalenie serca-↓ naciek komórek jednojądrzastych w sercu-↓ martwica serca | [ 119 ] |
| 4. Udar mózgu, noworodkowa encefalopatia niedotlenieniowo-niedokrwienna , zapalenie mózgu związane z sepsą | ||||
| Prosiaczek (noworodek) | Niedotlenienie i niedrożność tętnic szyjnych (20 min) + okres po HI (6 godz.); model noworodkowego HIE | 0,1 mg/kg; 15 minut i 240 minut po HI; IV | -↓ mózgowe upośledzenie hemodynamiczne i metaboliczne-↑ aktywność mózgu (amplituda EEG)-↓ drgawki-↓ utrata neuronów i degeneracja neuronów w korze i hipokampie-↓ troponina T we krwi-↓ Wywołany przez HI spadek MBP i wzrost HR-↓ Gazometria wywołana przez HI i zaburzenia oddechowe | [ 127 ] |
| Prosiaczek (noworodek) | Niedotlenienie i niedrożność tętnic szyjnych (40 min) + okres po HI (6 godz.); model noworodkowego HIE | 1 mg/kg; 30 minut po HI; IV | -↓ upośledzenie aktywności mózgu-↓ martwica neuronów w korze mózgowej-↑ liczba astrocytów w korze mózgowej-↓ ekscytotoksyczność w korze mózgowej-↓ stres oksydacyjny w korze mózgowej-↓ zapalenie układu nerwowego w korze mózgowej-↓ Spadek MBP wywołany HI-↔ pCO2 we krwi i obniżone pH krwi-↔ CO (efekty zależą od CB 2 i 5-HT 1A ) | [ 54 ] |
| Prosiaczek (noworodek) | Niedotlenienie i niedrożność tętnic szyjnych (20 min) + okres po HI (6 lub 72 godz.); model noworodkowego HIE | 0,1 mg/kg; 15 minut i 240 minut po HI; IV | -↑ aktywność mózgu (amplituda EEG)-↓ upośledzenie metabolizmu mózgu-↓ upośledzenie funkcji neurobehawioralnych-↓ zmiany histopatologiczne w mózgu-↓ Komórki TNF-α-dodatnie w mózgu-↓ S100B (marker uszkodzenia astrocytów) i enolaza specyficzna neuronalnie w płynie mózgowo-rdzeniowym | [ 128 ] |
| Prosiaczek (noworodek) | Niedotlenienie i niedrożność tętnic szyjnych (40 min) + okres po HI (6 godz.); model noworodkowego HIE | 1 mg/kg; 30 minut po HI; IV | -↓ upośledzenie aktywności mózgu-↓ martwica neuronów w korze mózgowej-↓ upośledzenie metabolizmu neuronalnego w korze mózgowej-↓ apoptoza w korze mózgowej-↓ ekscytotoksyczność w korze mózgowej-↓ stres oksydacyjny w korze mózgowej-↓ zapalenie układu nerwowego w korze mózgowej-↓ Spadek MBP wywołany HI-↔ pCO2 we krwi i obniżone pH krwi-↔ CO-↑ korzystny wpływ hipotermii na toksyczność wywołaną HI, zapalenie układu nerwowego, stres oksydacyjny i uszkodzenie neuronów w korze mózgowej | [ 129 ] |
| Prosiaczek (noworodek) | Niedotlenienie + okres po niedotlenieniu (9,5 godz.); model noworodkowego HIE | 1 mg/kg; 30 min po niedotlenieniu; IV | -↔ zmiany neuropatologiczne w korze mózgowej, hipokampie, istocie białej i móżdżku-↔ markery stresu oksydacyjnego w moczu-↔ zapalenie układu nerwowego w korze mózgowej i hipokampie-↔ apoptoza w korze mózgowej-↔ ekscytotoksyczność w hipokampie-↔ upośledzenie metabolizmu neuronalnego w korze mózgowej-↔ hemoglobina, mleczany, glukoza i troponina T we krwi-↔ NGAL w moczu (↓ NGAL w moczu, gdy zastosowano hipotermię)-↔ S100B (marker uszkodzenia astrocytów) w płynie mózgowo-rdzeniowym-↔ Indukowany HI spadek MBP i wzrost HR-↔ Nieprawidłowości w gazometrii wywołane przez HI-↔ korzystne działanie hipotermii | [ 137 ] |
| Prosiaczek (noworodek) | Niedotlenienie + okres po niedotlenieniu (6 godz.); model noworodkowego HIE | 1 mg/kg; 30 min po niedotlenieniu; IV | -↓ Spadek MBP wywołany HI-↑ aktywność mózgu (amplituda EEG)-↓ śmierć neuronów w mózgu ↓ zapalenie nerwów w mózgu-↓ stres oksydacyjny w mózgu-↓ obrzęk płuc i zmiany histologiczne oraz stany zapalne w płucach (wszystkie powyższe objawy zależą od 5-HT 1A )-↓ wymiana gazowa w płucach i ↑ całkowita pojemność płuc (działanie jest niezależne od 5-HT 1A )-↔ stres oksydacyjny w płucach-↔ CO i gazy krwi | [ 130 ] |
| Prosiaczek (noworodek) | Niedotlenienie + okres po niedotlenieniu (9,5 godz.); model noworodkowego HIE | 50 mg/ kg5 ; 30 min po niedotlenieniu; iv ponad 15 min. | -↓ MBP (istotne)-↔ HR, temperatura ciała, hemoglobina, mleczan i troponina T we krwi-↔ S100B (marker uszkodzenia astrocytów) w płynie mózgowo-rdzeniowym-↔ zmiany neuropatologiczne w mózgu-↔ ekscytotoksyczność w mózgu-↔ upośledzenie metabolizmu neuronalnego w mózgu | [ 132 ] |
| Prosiaczek (noworodek) | Niedotlenienie i niedrożność tętnic szyjnych (20 min) + okres po HI (54 godz.); model noworodkowego HIE | 1 mg/kg; 0,5, 24 i 48 godzin po HI; IV | -↑ aktywność mózgu (amplituda EEG)-↓ aktywacja mikrogleju w mózgu-↔ ekscytotoksyczność w mózgu-↔ upośledzenie metabolizmu neuronalnego w mózgu-↔ zapalenie układu nerwowego w mózgu-↔ apoptoza w mózgu-↔ stres oksydacyjny w mózgu-↔ aktywacja astrogleju-↓ Spadek MBP wywołany HI-↔ HR, Kolorado-↔ gazometrię krwi-↑ aktywność mózgu i ↓ aktywacja mikrogleju, ekscytotoksyczność, upośledzenie metabolizmu neuronalnego i zapalenie mózgu po zastosowaniu hipotermii | [ 131 ] |
| Myszoskoczek | Zamknięcie tętnic szyjnych (10 min) + reperfuzja (7 dni); model udaru | 1,25; 2,5; 5; 10 lub 20 mg/kg; 5 minut po okluzji; ip | -↓ Spłaszczenie EEG-↑ przeżycie neuronów w regionie CA 1 hipokampa-↓ hiperlokomocja 1 dzień po okluzji-↔ temperatura w odbycie 1 h po okluzji | [ 125 ] |
| Szczur | Okluzja MCA (90 min) + reperfuzja (2 dni); model udaru | 5 mg/kg; na początku okluzji; dożylnie + 20 mg/kg; 12 godzin po okluzji; ip | -↓ objętość zawału mózgu-↑ parametry behawioralne-↔ BP-↔ gazometria i poziom glukozy we krwi-↔ temperatura w odbycie | [ 120 ] |
| Szczur (noworodek) | Niedotlenienie (120 min) i elektrokoagulacja lewej tętnicy szyjnej + okres po HI (7 lub 30 dni); model noworodkowego HIE | 1 mg/kg; 10 minut po niedotlenieniu; sc | -↑ funkcja neurobehawioralna-↓ objętość zawału-↓ zmiany histopatologiczne w mózgu-↓ ekscytotoksyczność-↓ upośledzenie metabolizmu neuronalnego-↓ utrata neuronów-↓ stres oksydacyjny-↓ zapalenie układu nerwowego | [ 134 ] |
| Szczur (noworodek) | Okluzja MCA (3 godz.) + reperfuzja (1 tydzień lub 1 miesiąc); model udaru noworodkowego | 5 mg/kg; 15 min po okluzji; ip | -↑ funkcja neurobehawioralna-↔ objętość zawału-↓ objętość glejozy okołonerkowej-↓ utrata neuronów i apoptoza-↓ ekscytotoksyczność-↓ upośledzenie metabolizmu neuronalnego-↓ dysfunkcja astrocytów-↓ proliferacja i aktywacja mikrogleju | [ 123 ] |
| Szczur | okluzja MCA (1 godz.) + reperfuzja (1 dzień); model udaru | 50, 100 lub 200 ng; przez 5 dni przed okluzją; icv | -↓ całkowita objętość zawału półkuli mózgu, kory mózgowej, kory gruszkowatej, ciała migdałowatego i prążkowia-↓ Receptor TNF 1 i NF-KB łącznie w półkuli mózgu, korze i prążkowiu | [ 122 ] |
| Szczur (noworodek) | Niedotlenienie (112 min) i elektrokoagulacja lewej tętnicy szyjnej + okres po HI (30 dni); model noworodkowego HIE | 1 mg/kg; 10 minut po niedotlenieniu; sc | -↓ upośledzenie mielinizacji istoty białej i kory-↓ upośledzenie sprawności neurobehawioralnej-↔ Ekspresja BDNF i GDNF w korze 7 dni po HI | [ 135 ] |
| Mysz | okluzja MCA (4 godz.) + reperfuzja (20 godz.); model udaru | 0,1; 1; 3 lub 10 mg/kg; bezpośrednio przed okluzją i 3 godziny po rozpoczęciu okluzji; ip | -↓ objętość zawału (efekt zależny od 5-HT 1A ; niezależny od CB 1 i TRPV1)-↑ CBF podczas okluzji (efekt zależny od 5-HT 1A )-↔ MBP, HR (2 godziny po rozpoczęciu okluzji)-↔ gazometria i hematokryt przed reperfuzją | [ 53 ] |
| Mysz | okluzja MCA (4 godz.) + reperfuzja (20 godz. lub 3 dni); model udaru | 3 mg/kg; bezpośrednio przed okluzją i 3 godziny po rozpoczęciu okluzji; ip | -↓ objętość zawału (20 godzin lub 3 dni po okluzji)-↔ gazometria, hematokryt, K i Na we krwi (przed reperfuzją)-↔ MBP, HR (przed reperfuzją)-↔ temperatura w odbycie (przed reperfuzją)-↑ CBF podczas okluzji i przez 1 godzinę po okluzji-↓ Aktywność MPO w mózgu (1 i 20 h po okluzji; działanie jest niezależne od CB 1 i CB 2 )-↓ Komórki MPO-dodatnie w prążkowiu (20 godzin lub 3 dni po okluzji)-↑ koordynacja ruchowa (3 dni po okluzji) | [ 50 ] |
| okluzja MCA (4 godz.) + reperfuzja (20 godz.); model udaru | 0,1; 1 lub 3 mg/kg; bezpośrednio przed okluzją i 3 godziny po rozpoczęciu okluzji; ip | -↓ objętość zawału (efekt jest niezależny od CB 1 i CB 2 ) | ||
| 3 mg/kg; bezpośrednio przed okluzją lub 3, 4, 5, 6 h po rozpoczęciu okluzji; ip | -↓ objętość zawału-↔ ekscytotoksyczność w korze w ciągu 2 h od wystąpienia okluzji (CBD podane bezpośrednio przed okluzją)-↓ Aktywność MPO w mózgu (CBD podane 6 h po wystąpieniu okluzji) | |||
| Mysz | okluzja MCA (4 godz.) + reperfuzja (20 godz.); model udaru | 0,1; 1 lub 3 mg/kg; bezpośrednio przed okluzją i 3 godziny po rozpoczęciu okluzji; ip | -↓ objętość zawału (efekt niezależny od CB 1 i CB 2 ; zależny od 5-HT 1A )-↑ CBF podczas okluzji (efekt zależny od 5-HT 1A )-↔ gazometria, hematokryt, K i Na we krwi przed reperfuzją-↔ Ekspresja CB 1 w korze, prążkowiu i podwzgórzu | [ 50 ] |
| 3 mg/kg; przez 14 dni przed okluzją + bezpośrednio przed okluzją i 3 godziny po wystąpieniu okluzji; ip | -↓ objętość zawału (w zależności od 5-HT 1A )-↑ CBF podczas okluzji (efekt zależny od 5-HT 1A ) (efekty są porównywalne z obserwowanymi w grupie nieleczonej CBD przez 14 dni) -↔ temperatura w odbycie po 1 godzinie od wystąpienia okluzji-↔ gazometria, hematokryt, K i Na we krwi przed reperfuzją-↔ Ekspresja CB 1 w korze, prążkowiu i podwzgórzu | |||
| Mysz | okluzja MCA (4 godz.) + reperfuzja (20 godz.); model udaru | 0,1; 1 lub 3 mg/kg; bezpośrednio przed okluzją i 3 godziny po rozpoczęciu okluzji; ip | -↔ MBP, HR, pH, pCO 2 , hematokryt, Na, K, poziom glukozy we krwi, temperatura ciała (przed reperfuzją)-↓ objętość zawału (efekt jest niezależny od CB 1 i CB 2 )-↓ Aktywność MPO w mózgu (efekt jest niezależny od CB 1 i CB 2 )-↓ osocze HMGB1-↑ funkcje neurologiczne i koordynacja ruchowa | [ 121 ] |
| Okluzja MCA (4 godz.) + reperfuzja (3 dni); model udaru | 3 mg/kg; bezpośrednio przed okluzją i 3 godziny po rozpoczęciu okluzji; ip | -↓ osocze HMGB1-↓ Komórki HMGB1- i MPO-dodatnie w mózgu-↓ apoptoza w mózgu-↓ aktywacja glejów w mózgu-↑ funkcje neurologiczne i koordynacja ruchowa | ||
| Mysz | okluzja MCA (4 godz.) + reperfuzja (14 dni); model udaru | 3 mg/kg; przez 14, 12 lub 10 dni odpowiednio od dnia 1, 3 lub 5; ip | -↓ upośledzenie funkcji neurologicznych-↓ zaburzenia koordynacji ruchowej-↑ wskaźnik przeżycia-↓ apoptoza w mózgu-↓ liczba komórek mikrogleju (ale nie astrocytów) wyrażających HMGB1-↓ osocze HMGB1 (efekty dla CBD podawanego od 1. i 3. dnia, ale nie od 5. dnia) | [ 124 ] |
| Mysz (noworodek) | Skrawki przodomózgowia zostały pozbawione tlenu i glukozy; model in vitro noworodkowego HIE | 100 μmol/l | -↓ martwicza i apoptotyczna śmierć komórek-↓ ekscytotoksyczność-↓ zapalenie (efekty zależą od CB 2 i A 2 ; są niezależne od CB 1 ; ekscytotoksyczność jest również zależna od A 1 ) | [ 136 ] |
| Mysz | Zapalenie mózgu wywołane lipopolisacharydami; model zapalenia mózgu związanego z sepsą | 3 mg/kg; IV | -↓ rozszerzenie naczyń tętniczych i żylnych-↓ margines leukocytów-↓ integralność bariery krew-mózg-↓ zapalenie mózgu ↔ stres oksydacyjny w mózgu-↔ BP-↔ gazometrię krwi | [ 138 ] |
| Mysz | Zamknięcie tętnic szyjnych (17 min) + reperfuzja (7 dni); model udaru | 3, 10 lub 30 mg/kg; 30 min przed i 3, 24 i 48 h po okluzji; ip | -↓ neurodegeneracja hipokampa-↑ wydajność uczenia się przestrzennego-↓ odpowiedź astrogleju | [ 126 ] |
| Mysz (noworodek) | Niedotlenienie (90 min) i elektrokoagulacja lewej tętnicy szyjnej + okres po HI (7 dni); model noworodkowego HIE | 1 mg/kg; 15 minut, 1, 3, 6, 12, 18 lub 24 godziny po HI; sc | -↓ utrata objętości półkuli ipsilateralnej-↓ zmiany histopatologiczne-↓ apoptoza-↓ astroglioza-↓ aktywacja mikrogleju (efekty dla CBD podanego do 18 h po HI) -↓ zmiany histopatologiczne-↓ aktywacja mikrogleju (efekty dla CBD podanego 24 h po HI) | [ 133 ] |
| 5. Uszkodzenie niedokrwienne/reperfuzyjne nerek i wątroby | ||||
| Człowiek | Sinusoidalne komórki śródbłonka ludzkiej wątroby (HLSEC) stymulowane TNF-α | 1 µmol/l | -↓ cząsteczki adhezyjne ICAM-1 i VCAM-1-↓ adhezja komórek polimorfojądrowych do HLSEC (efekty są niezależne od CB 1 i CB 2 ) | [ 141 ] |
| Szczur | Okluzja szypuły lewego płata wątroby (30 min) + reperfuzja (72 h) | 5 mg/kg; 1 godzinę po okluzji, a następnie co 24 godziny przez 2 dni; IV | -↓ transaminaza alaninowa w surowicy-↓ zmiany histopatologiczne w wątrobie-↓ stres oksydacyjny i nitracyjny w wątrobie-↓ zapalenie wątroby-↓ apoptoza w wątrobie-↓ ekspresja NF-κB w wątrobie | [ 140 ] |
| Szczur | Zamknięcie nasady naczyń nerkowych (30 min) + reperfuzja (24 h) | 5 mg/kg; 1 h przed i 12 h po okluzji; IV | -↓ kreatynina w surowicy-↓ zmiany histopatologiczne w nerkach-↓ stres oksydacyjny i nitracyjny w nerkach-↓ zapalenie nerek-↓ apoptoza w nerkach-↓ ekspresja NF-κB w nerkach | [ 139 ] |
| Mysz | Zamknięcie tętnicy wątrobowej i żyły wrotnej (1 godz.) + reperfuzja (2, 6 lub 24 godz.) | 3 lub 10 mg/kg; 2 godziny przed lub 90 minut po okluzji; ip | -↓ transaminazy alaninowej i asparaginianowej w surowicy (efekt jest niezależny od CB 2 )-↓ zmiany histopatologiczne w wątrobie-↓ śmierć komórek w wątrobie-↓ zapalenie wątroby-↓ ICAM-1 w wątrobie-↓ naciek neutrofili w wątrobie-↓ Aktywacja NF-κB w wątrobie-↓ Aktywacja p38 MAPK i JNK w wątrobie-↓ stres oksydacyjny i nitracyjny w wątrobie-↓ dysfunkcja mitochondriów w wątrobie | [ 141 ] |
| 6. Cukrzyca i jej powikłania sercowo-naczyniowe | ||||
| Człowiek | Ludzkie komórki śródbłonka tętnic wieńcowych (HCAEC) narażone na działanie wysokiej glukozy | 1,5–6 μmol/l; 48 godz | -↓ cząsteczki adhezyjne ICAM-1 i VCAM-1-↓ adhezja monocytów do śródbłonka-↓ przezśródbłonkowa migracja monocytów-↓ zaburzenie funkcji bariery śródbłonkowej-↓ Aktywacja NF-κB (powyższe efekty są niezależne od CB 1 i CB 2 ) -↓ stres oksydacyjny i nitratywny | [ 146 ] |
| Człowiek | Ludzkie kardiomiocyty narażone na wysoką glukozę | 4 μmol/l; 48 godz | -↓ stres oksydacyjny i nitratywny-↓ apoptoza (za pośrednictwem modulacji aktywności Akt)-↓ Aktywacja NF-κB | [ 143 ] |
| Człowiek | Pacjenci z cukrzycą typu 2 2 ; izolowane tętnice krezkowe (wstępnie zwężone U46619 3 i endoteliną-1) | 0,1–100 μmol/l | -↓ odpowiedź wazorelaksacyjna | [ 56 ] |
| Człowiek | Pacjenci z cukrzycą typu 2 | 100 mg; dwa razy dziennie; przez 13 tygodni; po | -↔ SBP, DBP, HR-↔ poziom glukozy we krwi, kontrola glikemii i wrażliwość na insulinę-↔ profil lipidowy (cholesterol HDL, cholesterol LDL, cholesterol całkowity, trójglicerydy, apolipoproteiny A i B)-↔ masa ciała-↔ adiponektyna, ↓ rezystyna, ↑ GIP we krwi | [ 145 ] |
| Człowiek | Pacjenci z cukrzycą typu 2 4 ; izolowane tętnice płucne (wstępnie zwężone U46619 3 ) | 0,1–30 μmol/l | -↓ odpowiedź wazorelaksacyjna | [ 48 ] |
| Szczur | Cukrzyca indukowana streptozotocyną (model cukrzycy typu 1) | 10 mg/kg (co 2 dni); przez 1, 2 lub 4 tygodnie; ip | -↔ poziom glukozy we krwi-↔ masa ciała-↓ uszkodzenie bariery krew-siatkówka-↓ śmierć komórek nerwowych w siatkówce-↓ stres oksydacyjny i nitratywny w siatkówce-↓ zapalenie siatkówki-↓ VEGF w siatkówce-↓ aktywacja p38 MAPK w siatkówce | [ 142 ] |
| Szczur | ZDF (model cukrzycy typu 2); izolowana aorta i tętnica udowa | 10 µmol/l; 2 godz | -↑ odpowiedź wazorelaksacyjna na acetylocholinę (silniejsza niż przy kontroli normoglikemicznej) | [ 147 ] |
| Szczur | ZDF (model cukrzycy typu 2); izolowana tętnica udowa | 10 μmol/l; 2 godz | -↑ odpowiedź wazorelaksacyjna na acetylocholinę (silniejsza niż przy kontroli normoglikemicznej; działanie zależne od SOD, COX, EP 4 i CB 2 ; niezależne od śródbłonka, NO, H 2 O 2 , CB 1 , receptorów Abn-CBD i PPAR-γ)-odkrycie reakcji wazorelaksacyjnej na agonistę CB2 | [ 57 ] |
| Szczur | ZDF (model cukrzycy typu 2) | 10 mg/kg; przez 7 dni; ip | -↑ odpowiedź wazorelaksacyjna na acetylocholinę (ale nie na nitroprusydek sodu) w izolowanych tętnicach krezkowych (efekt zależy od COX i NO)-↔ odpowiedź wazorelaksacyjna na acetylocholinę i nitroprusydek sodu w aorcie i tętnicy udowej-↔ poziom glukozy we krwi-↓ przyrost masy ciała-↓ Peptyd C, insulina, leptyna, ICAM-1 w surowicy-↔ GLP-1, glukagon, MCP-1, polipeptyd trzustkowy, amylina, GIP, IL-6, TNF-α, peptyd YY, vWF, PAI-1 w surowicy-↑ VEGF i endotelina-1 w surowicy | [ 144 ] |
| Mysz | Cukrzyca indukowana streptozotocyną (model cukrzycy typu 1) | 1, 10 lub 20 mg/kg; przez 4 lub 11 tygodni; ip | -↔ poziom glukozy we krwi, zawartość insuliny w trzustce-↔ masa ciała-↓ dysfunkcja lewej komory-↓ stres oksydacyjny i nitratywny w sercu-↓ zapalenie i aktywacja NF-κB w sercu-↓ apoptoza i aktywacja MAPK w sercu-↓ zwłóknienie mięśnia sercowego-↓ aktywacja NF-κB, JNK, p38 i p38α MAPK w sercu-↑ aktywacja Akt w sercu | [ 143 |
1 Efekty zaobserwowane przy co najmniej jednej z badanych dawek/stężeń; 2 pacjentów z nowotworem lub chorobą zapalną jelit; 3 agonista receptora tromboksanu; 4 chorych na raka płuc; 5 w przypadku wystąpienia znaczących skutków ubocznych dawkę zmniejszano stopniowo do 25 i 10 mg/kg. ↑/↓/↔ — wzrost/spadek/brak zmian; skróty: 4-HHE: 4-Hydroksyheksenal; 5-HT 1A, 3 : Receptory serotoninowe typu 1A, 3; Abn-CBD: nieprawidłowy kannabidiol; A 1, 2 : Receptor adenozynowy typu 1, 2; Akt: Kinaza białkowa B; BDNF: czynnik neurotroficzny pochodzenia mózgowego; BNST: jądro łoża prążkowia końcowego; BP: ciśnienie krwi; CB 1, 2 : Receptor kannabinoidowy typu 1, 2; CBF: mózgowy przepływ krwi; CK, CK-MB: Kinaza kreatynowa i jej izoenzym sercowy; CO: pojemność minutowa serca; COX: cyklooksygenaza; CRP: białko C-reaktywne; CSF: płyn mózgowo-rdzeniowy; DBP: rozkurczowe ciśnienie krwi; Sól DOCA: Sól octanu dezoksykortykosteronu; EEG: elektroencefalograficzne; EF: frakcja wyrzutowa; EJT: czas wyrzutu lewej komory; FMD: dylatacja za pośrednictwem przepływu; GDNF: czynnik neurotroficzny pochodzenia glejowego; GIP: zależny od glukozy peptyd insulinotropowy; GIP: zależny od glukozy peptyd insulinotropowy; GLP-1: glukagonopodobny peptyd-1; HDL: lipoproteina o dużej gęstości; HI: Niedotlenienie-niedokrwienie; HIE: Encefalopatia niedotlenieniowo-niedokrwienna; HMGB1: grupa o wysokiej mobilności 1; HR: tętno; ic: Wewnątrzoponowo; icv: komora mózgowa; ip: dootrzewnowo; iv: Dożylnie; ICAM-1: cząsteczka adhezji międzykomórkowej 1; IL-6: interleukina 6; JNK: N-końcowa kinaza c-Jun; LAD: lewa tętnica zstępująca przednia; LCx: lewa tętnica wieńcowa okalająca; LDH: dehydrogenaza mleczanowa; LDL: lipoproteina o małej gęstości; MAPK: kinazy białkowe aktywowane mitogenami; MBP: średnie ciśnienie krwi; MCA: tętnica środkowa mózgu; MCP-1: Białko chemoatraktacyjne monocytów-1; MDA: dialdehyd malonowy; po: Per os, ustnie; MMP2, 9: metaloproteinaza macierzy 2, 9; MPO: mieloperoksydaza; NF-кB: współczynnik jądrowy κB; PAI-1: Inhibitor aktywatora plazminogenu-1; PPAR-γ: receptor γ aktywowany przez proliferatory peroksysomów; PWV: prędkość fali pulsacyjnej; S100B: S100 białko B wiążące wapń; sc: podskórnie; SBF: przepływ krwi w skórze przedramienia; SBP: skurczowe ciśnienie krwi; SHR: szczur ze spontanicznym nadciśnieniem; SOD: dysmutaza ponadtlenkowa; SV: objętość skurczowa; TNF-α: czynnik martwicy nowotworu α; TPR: całkowity opór obwodowy; TRPV1: członek 4 podrodziny waniloidów o potencjale przejściowym; VCAM-1: białko adhezyjne komórek naczyniowych 1; VEGF: czynnik wzrostu śródbłonka naczyniowego; vWF: czynnik von Willebranda; ZDF: Zucker Diabetic Fatty Rat.
4.2. Nadciśnienie tętnicze
Nadciśnienie tętnicze wiąże się ze zmianami w układzie endokannabinoidowym (np. wzrostem AEA w osoczu), co może wskazywać na jego aktywację. Kannabinoidy podawane zwierzętom z nadciśnieniem często powodują zmianę odpowiedzi hemodynamicznej – pojawia się lub nasila faza hipotensyjna. Hamowanie FAAH może wywierać działanie hipotensyjne, które zależy od wieku zwierząt i doświadczalnego modelu nadciśnienia. Endokannabinoidy wykazały również modulujący wpływ na stres oksydacyjny i stany zapalne w nadciśnieniu, które są ważną częścią patogenezy tej choroby [ 19 , 20 , 27 , 113 , 114 ]. Biorąc pod uwagę zarówno działanie wazorelaksacyjne, modulację procesów zapalnych i oksydacyjnych, jak i metabolizm endokannabinoidów [ 23 , 27 , 30 , 31 , 71 ], można spodziewać się pewnych korzyści z ich stosowania w leczeniu nadciśnienia.
Dotychczas przeprowadzono badania na dwóch szczurzych modelach nadciśnienia (Tabela 4) — u szczurów z samoistnym nadciśnieniem (SHR; model nadciśnienia pierwotnego) i nadciśnienia indukowanego solą octanu deoksykortykosteronu (sól DOCA; model nadciśnienia wtórnego) [ 48 , 52 , 96 ]. Badania na izolowanych małych tętnicach krezkowych wykazały przeciwne działanie CBD w tych dwóch modelach. W pierwszym przypadku działanie wazorelaksacyjne CBD zostało zmniejszone, podczas gdy w drugim wzmocnione [ 48 ]. Te przeciwne efekty mogą wynikać z odmiennej patogenezy i zmian w układzie endokannabinoidowym w zastosowanych modelach nadciśnienia tętniczego [ 20 ]. Ponadto w tych dwóch modelach zaobserwowano również pewne różnice w mechanizmie działania rozszerzającego naczynia CBD (patrzTabela 4) [ 48 ]. Podobnie jak w przypadku SHR, działanie CBD rozszerzające naczynia w izolowanych tętnicach płucnych było zmniejszone u pacjentów z nadciśnieniem tętniczym [ 48 ]. Jednakże nie zaobserwowano żadnych zmian w odpowiedzi wazorelaksacyjnej na CBD w izolowanych tętnicach krezkowych osób z nadciśnieniem [ 56 ].
U przytomnych szczurów ze spontanicznym nadciśnieniem podanie ip CBD spowodowało wzrost ciśnienia krwi w pierwszych minutach po wstrzyknięciu nieco silniejszy niż w przypadku kontroli normotensyjnej [ 52 ]. Może to zatem wynikać z upośledzonego działania rozszerzającego naczynia CBD ujawnionego w SHR [ 48 ]. Jednakże efekty hemodynamiczne w SHR z rdzeniem i wagotomią (wzrost SBP i HR oraz zmniejszenie DBP) były porównywalne z grupą kontrolną [ 52 ]. U SHR znieczulonych uretanem szybkie podanie dożylne CBD wywołało silniejszy odruch Bezolda-Jarischa niż u zwierząt kontrolnych [ 52 ]. Podczas dwutygodniowego podawania CBD szczurom SHR i DOCA z solą nie zaobserwowano znaczącego wpływu na ciśnienie krwi i częstość akcji serca. Jednocześnie jednak stwierdzono spadek markerów stresu oksydacyjnego w osoczu i sercu tych zwierząt [ 96 ]. Podsumowując, dotychczasowe badania nie wykazały hipotensyjnego działania CBD w leczeniu nadciśnienia tętniczego, choć związek ten wykazuje w tej chorobie właściwości antyoksydacyjne.
4.3. Niedokrwienie/zawał mięśnia sercowego, kardiomiopatie, zapalenie mięśnia sercowego
Już wcześniej postulowano wysoki potencjał kardioprotekcyjny CBD (Tabela 4). Kilka badań wskazuje na korzystny wpływ na niedokrwienie/ zawał mięśnia sercowego, który uzyskano na zwierzętach doświadczalnych poprzez podwiązanie lewej tętnicy zstępującej przedniej u szczurów [ 49,105,115 ] lub lewej tętnicy wieńcowej okalającej u królików [ 116 ] . Podanie CBD przed podwiązaniem tętnicy wieńcowej i bezpośrednio przed reperfuzją zmniejszyło wielkość zawału. Dodatkowo CBD podawane przed indukcją niedokrwienia zmniejszało liczbę komorowych zaburzeń rytmu i zmniejszało agregację płytek krwi indukowaną kolagenem. Działanie antyarytmiczne CBD może wynikać z hamowania uwalniania substancji arytmogennych z płytek krwi [ 105 ]. Inne badanie wykazało, że antyarytmiczne działanie CBD na komorowe zaburzenia rytmu wywołane niedokrwieniem/reperfuzją zależy od receptorów adenozyny A 1 [ 49 ]. U królików CBD podawane przed eksperymentalnie wywołanym ostrym zawałem mięśnia sercowego zmniejszało rozmiar zawału, zwiększało przepływ krwi w obszarze z upośledzoną perfuzją, zmniejszało poziom troponiny sercowej I we krwi i zmniejszało apoptozę komórek mięśniowych. Ponadto CBD poprawiło funkcję lewej komory i chroniło przed uszkodzeniem reperfuzyjnym, co było związane ze zmniejszonym naciekiem leukocytów w sercu [ 116 ]. Przewlekłe leczenie CBD zmniejszyło również rozmiar zawału i naciek leukocytów serca w szczurzym modelu niedokrwienia i reperfuzji. Działania te były związane ze zmniejszonym poziomem interleukiny 6 w surowicy. Jednakże zmniejszenie rozmiaru zawału przez CBD zaobserwowano tylko in vivo, ale nie w izolowanych sercach. Zatem kardioprotekcyjne działanie CBD w zawale mięśnia sercowego nie wydaje się być bezpośrednie i może wynikać z jego właściwości przeciwzapalnych [ 115 ].
Kannabidiol wykazuje również potencjalne korzystne działanie w przypadku innych chorób serca (Tabela 4). Na przykład osłabia kardiotoksyczność doksorubicyny (antracyklinowego antybiotyku przeciwnowotworowego) u szczurów. Przewlekłe podawanie CBD przez cztery tygodnie zmniejszyło wywołane doksorubicyną zmiany histopatologiczne w sercu i podwyższyło w surowicy markery uszkodzenia mięśnia sercowego – kinazy kreatynowej i troponiny T. Kardioprotekcyjne działanie CBD było związane ze zmniejszeniem poziomu dialdehydu malonowego w sercu, tlenku azotu, czynnika martwicy nowotworu α ( TNF-α) i poziom jonów wapnia, zwiększony poziom zredukowanego glutationu, selenu i cynku w sercu, zmniejszona ekspresja NF-KB, indukowalnego NOS i kaspazy-3 oraz zwiększona ekspresja surwiwiny [ 117 ]. W innym badaniu leczenie CBD przez pięć dni poprawiło dysfunkcję serca wywołaną doksorubicyną, zmniejszyło aktywność kinazy kreatynowej i dehydrogenazy mleczanowej w surowicy (markery uszkodzenia serca). Podobnie jak w poprzednim badaniu, leczenie CBD znacznie zmniejszyło stres oksydacyjny i nitratywny oraz śmierć komórek w kardiomiopatii wywołanej doksorubicyną. Ponadto CBD wzmocniło upośledzoną funkcję mitochondriów serca i biogenezę w tej patologii [ 118 ]. W modelu eksperymentalnego autoimmunologicznego zapalenia mięśnia sercowego u myszy zastrzyki z CBD poprawiły właściwości skurczowe i rozkurczowe lewej komory, jednocześnie zmniejszając jej przebudowę zwłóknieniową, stan zapalny, martwicę i naciek jednojądrowy. Badania biochemiczne potwierdziły złagodzenie stanu zapalnego związane ze zmniejszoną ekspresją cytokin prozapalnych (interleukiny 6 i 1β oraz interferonem-γ) oraz poziomem sercowego 4-hydroksynonenalu i 3-nitrotyrozyny (odpowiednio markerów stresu oksydacyjnego i nitracyjnego) [ 119 ]. Właściwości kardioprotekcyjne CBD wykazano także w zwierzęcym modelu cukrzycy (patrz poniżej).
4.4. Udar mózgu, noworodkowa encefalopatia niedotlenieniowo-niedokrwienna, zapalenie mózgu związane z sepsą
Właściwości neuroprotekcyjne CBD wykazano w szerokiej gamie modeli zwierzęcych zaburzeń neurologicznych, w tym epilepsji, choroby Alzheimera, choroby Huntingtona, choroby Parkinsona i stwardnienia rozsianego [ 11 , 17 , 30 , 66 ]. Istnieją również pewne dowody (np.Tabela 4) pod kątem korzystnego wpływu CBD na zaburzenia mózgu związane z niedotlenieniem i/lub niedokrwieniem, takie jak udar i noworodkowa encefalopatia niedotlenieniowo-niedokrwienna (HIE).
Wpływ kannabidiolu na udar niedokrwienny mózgu badano głównie na myszach i szczurach z niedrożnością tętnicy środkowej mózgu (Tabela 4). W tym modelu udaru CBD podawane zarówno przed, jak i/lub po niedokrwieniu zmniejszało objętość zawału [ 50 , 53 , 120 , 121 , 122 ] (ale nie u nowonarodzonych szczurów [ 123 ]) i poprawiało upośledzone funkcje neurologiczne i/lub neurobehawioralne [ 50 , 120 , 121 , 122 , 123 , 124 ]. CBD zwiększa mózgowy przepływ krwi podczas okluzji [ 50,53 ] , co jest zgodne z metaanalizą Sultana i in . [ 24 ], które wskazywały na zwiększone CBF w mysich modelach udaru po podaniu CBD. Ponadto jedno badanie wykazało, że CBD hamowało również spadek CBF z powodu niewydolności mikrokrążenia mózgowego przez 1 godzinę po reperfuzji [ 50 ]. Wpływ CBD na objętość zawału i CBF odbywał się, przynajmniej częściowo, za pośrednictwem receptorów serotoninowych 5-HT 1A i nie był zależny od receptorów kannabinoidowych i receptorów waniloidowych TRPV1 [ 50 , 53 , 121 ]. Co ważne, powtarzane leczenie CBD przez 14 dni przed okluzją nie wykazało rozwoju tolerancji na jego właściwości neuroprotekcyjne [ 50 ]. Wykazano, że CBD wykazuje właściwości neuroprotekcyjne przy podawaniu nawet po dłuższym czasie od niedokrwienia mózgu. Zatem powtarzane leczenie CBD najpóźniej od pierwszego lub trzeciego dnia po indukcji udaru poprawiło deficyty funkcjonalne, wskaźniki przeżycia i uszkodzenia niedokrwienne [ 124 ]. U myszoskoczków i szczurów narażonych na niedokrwienie mózgu wywołane obustronnym zamknięciem tętnicy szyjnej wykazano działanie ochronne CBD przed neurodegeneracją hipokampa i zaburzeniami funkcji poznawczych lub nadpobudliwością ruchową [ 125,126 ]. Neuroprotekcyjne działanie CBD w zwierzęcych modelach udaru było związane ze zmniejszoną ekscytotoksycznością [ 123 ] , aktywacją glejów [ 121,123,124,126 ] , upośledzeniem metabolizmu neuronalnego [ 123 ] i apoptozą [ 121,123,124 ] . CBD zmniejszyło także zapalenie układu nerwowego wywołane udarem, ponieważ zmniejszyło liczbę komórek dodatnich pod względem mieloperoksydazy (neutrofili) [ 50,121 ] i zmniejszyło ekspresję czynników zapalnych, takich jak receptor TNF-α 1 i NF-KB w mózgu [ 122] Ponadto CBD może łagodzić urazy po niedokrwieniu poprzez hamowanie białka grupy 1 o wysokiej ruchliwości (HMGB1). To niehistonowe białko wiążące DNA jest masowo uwalniane do przestrzeni zewnątrzkomórkowej z komórek zapalnych i martwiczych po niedokrwieniu i indukuje ekspresję genów związanych z zapaleniem układu nerwowego i aktywacją mikrogleju. Rzeczywiście, leczenie CBD zmniejszyło poziom HMGB1 w osoczu i liczbę komórek HMGB1-dodatnich w mózgu myszy poddanych ogniskowemu niedokrwieniu mózgu [ 121,124 ] . Należy zauważyć, że w niedokrwieniu mózgu CBD wywołało pewne korzystne skutki w postaci zależnej od dawki krzywej dzwonowej. Zatem zapobieganie spłaszczeniu elektroencefalograficznemu było największe przy dawce 5 mg/kg CBD (1,25–20 mg/kg) [ 125 ] i zmniejszeniu objętości zawału przy dawce 1 mg/kg CBD (0,1–10 mg/kg) [ 53 ].
Najczęstszą przyczyną uszkodzeń mózgu u noworodków jest okołoporodowa encefalopatia niedotlenieniowo-niedokrwienna spowodowana uduszeniem. Kannabidiol jest uważany za obiecujący środek neuroprotekcyjny w leczeniu niedotlenienia-niedokrwienia noworodków i jak wspomniano powyżej, w Unii Europejskiej związek ten ma nawet status leku sierocego w leczeniu zamartwicy okołoporodowej. Najwięcej dowodów na ochronne działanie CBD w HIE opiera się na badaniach na nowonarodzonych prosiętach poddanych niedotlenieniu i niedokrwieniu [ 54,127,128,129,130,131 ] (Tabela 4). Korzystny wpływ CBD na eksperymentalny HIE noworodków obejmuje złagodzenie zmniejszonej aktywności mózgu [ 54,127,128,129,130,131 ] , upośledzenie metabolizmu neuronalnego [ 127,128,129,131 ] , ekscytotoksyczność [ 54,129 ] , zmiany histopatologiczne w mózgu [ 127 , 128 ], martwica i/lub apoptoza neuronów [ 54 , 129 , 130 , 131 ], aktywacja astrogleju i/lub mikrogleju [ 131 ], zapalenie nerwów [ 54 , 128 , 129 , 130 , 131 ] i stres oksydacyjny w mózg [ 54 , 130 , 131 ]. CBD może również zmniejszać odległe zapalne uszkodzenia płuc związane z uszkodzeniem mózgu wywołanym niedotlenieniem i niedokrwieniem [ 130 ]. Ponadto CBD może zmniejszać spadek ciśnienia krwi wywołany niedotlenieniem i niedokrwieniem [ 54,127,129,130,131 ] . Jednakże wysoka dawka CBD (50 i 25 mg/kg; najczęstsza dawka w poprzednich badaniach wynosiła 1 mg/kg) wywołała znaczne niedociśnienie u niektórych prosiąt (CBD 50 mg/kg u dwóch z czterech prosiąt i CBD 25 mg/kg kg u jednego na cztery prosięta). Ponadto u jednego prosiaka doszło do śmiertelnego zatrzymania akcji serca po wlewie CBD w dawce 50 mg/kg [ 132 ]. Dlatego należy zachować ostrożność podczas leczenia dużymi dawkami CBD ze względu na możliwość wystąpienia działań niepożądanych ze strony układu sercowo-naczyniowego. Korzystne działanie CBD wykazano także w mysich [ 133 ] i szczurzych modelach [ 134 , 135 ] noworodkowego HIE (Tabela 4). Warto zauważyć, że CBD wykazuje szersze okno czasu terapeutycznego niż zgłaszane w przypadku hipotermii i innych terapii neuroprotekcyjnych [ 133 ]. Ochronne działanie CBD w przypadku uszkodzenia mózgu wywołanego niedotlenieniem i niedokrwieniem zachodzi, przynajmniej częściowo, poprzez receptory CB 2 i 5-HT 1A [ 54 , 130 ]. Badania na skrawkach przodomózgowia nowonarodzonych myszy poddanych pozbawieniu tlenu i glukozy wykazały, że oprócz receptorów CB2 , receptory adenozynowe (głównie A2 ) mogą również pośredniczyć w neuroprotekcyjnym działaniu CBD [ 136 ]. Jednakże niektórzy autorzy podali, że CBD ( w niskich lub wysokich dawkach ) nie wykazywało żadnych właściwości neuroprotekcyjnych w modelach eksperymentalnych noworodkowego HIE [ 137 ]. Niemniej jednak CBD może zwiększyć ochronne działanie hipotermii, co jest złotym standardem w leczeniu niemowląt z HIE [ 129 , 131 ].
Przeciwzapalne i stabilizujące naczynia działanie CBD wykazano także w przypadku mysiego zapalenia mózgu wywołanego podaniem lipopolisacharydu (LPS) (Tabela 4). LPS powodował rozszerzenie naczyń tętniczych i żylnych, zwiększoną marginalizację leukocytów, zwiększoną ekspresję prozapalnych TNF-α i COX-2, wyższy poziom markerów stresu oksydacyjnego (dialdehydu malonowego i 4-hydroksynonenalu) oraz zaburzenie bariery krew-mózg. Leczenie CBD złagodziło prawie wszystkie zmiany wywołane LPS (z wyjątkiem markerów stresu oksydacyjnego), a dodatkowo zmniejszyło indukowaną ekspresję NOS. Zatem CBD może stanowić opcję leczenia zapalenia mózgu i encefalopatii związanego z sepsą [ 138 ].
4,5. Niedokrwienie/uszkodzenie reperfuzyjne nerek i wątroby
Wykazano, że kannabidiol chroni przed uszkodzeniem nerek i wątroby w wyniku niedokrwienia/reperfuzji (Tabela 4). Tego typu uszkodzenia mogą wystąpić podczas wstrząsu oraz operacji lub przeszczepienia tych narządów. W szczurzym modelu uszkodzenia nerek z powodu niedokrwienia/reperfuzji, CBD znacząco zmniejszyło zmiany histopatologiczne w nerkach i obniżyło poziom kreatyniny w surowicy (marker czynności nerek). Nefroprotekcyjne działanie CBD było związane ze złagodzeniem stresu oksydacyjnego i nitracyjnego wywołanego niedokrwieniem/reperfuzją, stanem zapalnym i apoptozą [ 139 ]. Podobne działanie ochronne uzyskano u gryzoni poddanych niedokrwieniu/reperfuzji wątroby. Zatem CBD zmniejszyło transaminazy w surowicy (markery uszkodzenia wątroby) i zmiany histopatologiczne, śmierć komórek, stres oksydacyjny i nitracyjny oraz zapalenie wątroby [ 140,141 ] . Wykazano, że mechanizm tego działania hepatoprotekcyjnego może obejmować osłabioną aktywację NF-κB, p38 MAPK i JNK przez CBD [ 141 ]. Badania in vitro na komórkach sinusoidalnych ludzkiej wątroby wykazały, że CBD może osłabiać indukowaną przez TNF-α ekspresję cząsteczek adhezyjnych (ICAM-1 i VCAM-1) oraz adhezję komórek wielojądrzastych do komórek sinusoidalnych wątroby. Odpowiada to indukowanemu przez CBD zmniejszeniu ekspresji ICAM-1 i naciekowi neutrofili w wątrobie myszy poddanej uszkodzeniu niedokrwiennemu/reperfuzyjnemu [ 141 ]. Wydaje się, że hepatoprotekcyjne działanie CBD nie jest zależne od receptorów kannabinoidowych, ponieważ nie zostało osłabione przez antagonistów CB 1 i CB 2 in vitro i nadal występowało u myszy z nokautem CB 2 [ 141 ]. Podsumowując, CBD ma ogromny potencjał terapeutyczny w zapobieganiu i łagodzeniu uszkodzeń niedokrwiennych/reperfuzyjnych różnych narządów, takich jak serce, mózg, nerki i wątroba.
4.6. Powikłania sercowo-naczyniowe cukrzycy
Cukrzyca powoduje wiele powikłań związanych z sercem i naczyniami krwionośnymi, takich jak miażdżyca, retinopatia lub kardiomiopatia, które są związane z dysfunkcją śródbłonka naczyń, zwiększonym stanem zapalnym i stresem oksydacyjnym. CBD nie wpływa na poziom glukozy we krwi u zwierząt chorych na cukrzycę [ 142 , 143 , 144 ] i ludzi [ 145 ]. Ponadto u pacjentów z cukrzycą typu 2 CBD nie wpływało na kontrolę glikemii, wrażliwość na insulinę, profil lipidowy, masę ciała i parametry hemodynamiczne [ 145 ]. Jednakże, ze względu na swoje właściwości przeciwutleniające, przeciwzapalne oraz naczyniowe, kardiologiczne i neuroprotekcyjne, CBD może łagodzić powikłania sercowo-naczyniowe cukrzycy (Tabela 4).
Zakłócenie funkcji i integralności śródbłonka jest niezbędne dla rozwoju różnych powikłań cukrzycy. W ludzkich komórkach śródbłonka tętnic wieńcowych narażonych na działanie wysokiej glukozy wykazano zwiększone wytwarzanie mitochondrialnych nadtlenków, tworzenie 3-nitrotyrozyny, aktywację NF-κB, indukowalną ekspresję NOS i cząsteczek adhezyjnych, przezśródbłonkową migrację monocytów i ich adhezję do śródbłonka. Wstępne leczenie CBD złagodziło wszystkie te negatywne skutki. Ponadto poprawił także zaburzenia funkcji bariery śródbłonkowej wywołane wysokim poziomem glukozy. Ochronne działanie CBD na komórki śródbłonka było niezależne od CB 1 i CB 2 [ 146 ].
Wpływ CBD na funkcję naczyń krwionośnych badano u szczurów Zucker Diabetic Fat Rats (ZDF) — model cukrzycy typu 2. Inkubacja in vitro z CBD wzmocniła działanie rozszerzające naczynia krwionośne acetylocholiny w izolowanej aorcie i tętnicy udowej, a efekt ten był silniejszy w porównaniu ze zwierzętami kontrolnymi z normoglikemią [ 57,147 ] . Badania badające mechanizm działania w tętnicach udowych wykazały, że CBD aktywuje cyklooksygenazę, a następnie indukuje wytwarzanie związków aktywujących rozszerzające naczynia receptory prostanoidowe EP 4 . Co więcej, działanie CBD było zależne od dysmutazy ponadtlenkowej i receptorów CB2 . Co ciekawe, w tętnicach udowych ZDF CBD odkryło działanie rozszerzające naczynia krwionośne agonisty receptora CB 2 HU308 (związek ten bez obecności CBD nie wykazywał działania rozszerzającego naczynia) [ 57 ]. Kannabidiol może również poprawiać rozluźnienie naczyń u szczurów z cukrzycą po leczeniu in vivo. Zatem wielokrotne podawanie CBD przez siedem dni znacząco zwiększało rozszerzenie naczyń do acetylocholiny w izolowanych tętnicach krezkowych (ale nie w aorcie i tętnicach udowych), a efekt ten był wrażliwy na hamowanie COX i NOS. Ponadto CBD zmniejszyło niektóre biomarkery metaboliczne i sercowo-naczyniowe w surowicy (patrzTabela 4). Jednakże, co ciekawe, zwiększył poziom krążącej endoteliny 1, co jest niespójne z poprawą funkcji naczyń [ 144 ]. Warto zauważyć, że u ludzi chorych na cukrzycę typu 2 CBD nie tylko nie wykazywało zwiększonych właściwości rozszerzających naczynia (w izolowanych tętnicach płucnych) [ 48 ], ale reakcje wazorelaksacyjne CBD były osłabione (w tętnicach krezkowych) [ 144 ].
Leczenie kannabidiolem może być korzystne w przypadku retinopatii cukrzycowej, która charakteryzuje się zwiększoną przepuszczalnością naczyń i neurotoksycznością. U szczurów z cukrzycą indukowaną streptozotocyną (model cukrzycy typu 1) przewlekłe podawanie CBD poprawiło funkcję bariery krew-siatkówka, zmniejszyło stres oksydacyjny i nitratywny, obniżyło poziom TNF-α i ICAM-1 oraz zapobiegło śmierci komórek nerwowych w siatkówce. Ponadto CBD obniżyło w siatkówce poziom czynnika wzrostu śródbłonka naczyniowego (VEGF), co powiązano z rozkładem bariery krew-siatkówka [ 142 ]. I odwrotnie, CBD zwiększyło krążący VEGF u szczurów ZDF, zatem wpływ CBD na tego mediatora wymaga dalszych badań [ 144 ]. Właściwości ochronne CBD w siatkówce cukrzycowej mogą wynikać z hamowania aktywacji p38 MAPK. Ta kinaza białkowa jest dalszym celem stresu oksydacyjnego i cytokin prozapalnych, a jej aktywacja może zwiększać przepuszczalność naczyń i śmierć komórek, kluczowe elementy patogenezy retinopatii cukrzycowej [ 142 ].
Kolejnym powikłaniem cukrzycy jest kardiomiopatia, charakteryzująca się dysfunkcją rozkurczową, a następnie skurczową lewej komory. Patogeneza kardiomiopatii cukrzycowej jest złożona i obejmuje stres oksydacyjny/nitracyjny, stan zapalny, zwłóknienie serca i śmierć kardiomiocytów. U myszy z cukrzycą indukowaną streptozotocyną, przewlekle podawany CBD łagodzi wszystkie te zmiany poprzez hamowanie szlaków prozapalnych i śmierci komórkowej (NF-κB, p38 i p38α MAPK, JNK) oraz wzmacnianie szlaku sygnalizacyjnego prosuvival (Akt) [143 ] . Podobnie w ludzkich kardiomiocytach CBD eliminowało niekorzystne skutki hiperglikemii poprzez zmniejszenie stresu oksydacyjnego i nitracyjnego, aktywację NF-κB i apoptozę komórek [ 143 ].
5. Wpływ nieprawidłowego kannabidiolu na układ sercowo-naczyniowy
Nieprawidłowy-kannabidiol (struktura chemicznaRysunek 4) jest syntetycznym regioizomerem kanabidiolu, który we wstępnych badaniach nie wykazywał jawnych skutków behawioralnych [ 51 , 148 , 149 ]. Abn -CBD powoduje niedociśnienie u znieczulonych psów [ 148 ] i myszy [ 51,150 ] po podaniu ogólnoustrojowym oraz rozszerzenie naczyń w izolowanych myszach i łożysku krezkowym szczura [ 51 ] , tętnicach krezkowych szczura [ 150,151,152 ] i szczurze [ 153 ], królika [ 154 ] i ludzkie tętnice płucne [ 155 ]. Efekty te nie są zależne od receptorów kannabinoidowych. Działanie wazorelaksacyjne Abn-CBD zachodzi hipotetycznie poprzez niezidentyfikowany receptor śródbłonkowy zwany receptorem Abn-CBD lub śródbłonkowy receptor kannabinoidowy i jest hamowane przez CBD i O-1918, domniemanych antagonistów tego receptora [ 51 , 71 , 73 ]. Jednak w oparciu o obecną wiedzę istnienie specyficznego śródbłonkowego receptora dla Abn-CBD jest dość kontrowersyjne. Abn-CBD jest agonistą GPR18, a O-1918 i CBD służą odpowiednio jako antagonista lub częściowy agonista/antagonista tego receptora [ 73 , 156 ]. Dlatego niektórzy autorzy sugerują, że proponowanym śródbłonkowym receptorem kannabinoidowym może być GPR18. Jednak nie wszystkie obserwacje eksperymentalne potwierdzają to jednoznacznie [ 73 ]. Ponadto niezależna od GPR18 aktywacja kanałów K + (BK Ca ) o wysokim przewodnictwie aktywowanych Ca 2+ może przyczyniać się do rozszerzającego naczynia działania Abn-CBD [ 157 ]. Abn-CBD może również obniżać ciśnienie krwi po podaniu wewnątrz RVLM poprzez aktywację GPR18, co prowadzi do hamowania sympatotropii [ 158 ]. Ponadto związek ten jest agonistą GPR55, jednakże receptor ten nie pośredniczy w odpowiedzi wazorelaksacyjnej na Abn-CBD [ 150 ].
Rysunek 4
Struktura chemiczna nieprawidłowego kannabidiolu.
Przewlekle podawany Abn-CBD wywierał korzystny wpływ na układ sercowo-naczyniowy u szczurów poprzez obniżenie średniego ciśnienia krwi, zwiększenie stężenia adiponektyny w osoczu i sercu, zwiększenie dostępności NO w naczyniach, poprawę funkcji lewej komory czy zmniejszenie reaktywnych form tlenu w sercu [ 159 ] Abn-CBD wykazało także działanie kardioprotekcyjne u szczurów z cukrzycą wywołaną streptozocyną. Łagodził dysfunkcję serca (ale nie przerost serca), dominację nerwu błędnego, stres oksydacyjny mięśnia sercowego oraz zmniejszał poziom NO i adiponektyny w sercu i/lub krążeniu u szczurów z cukrzycą [ 160 ]. Wszystkie te korzystne efekty zostały zniesione przez O-1918, wskazując na rolę GPR18 w działaniu ochronnym Abn-CBD w układzie sercowo-naczyniowym [ 159 , 160 ]. Kardioprotekcji obserwowanej u szczurów z cukrzycą nie towarzyszyła poprawa kontroli glikemii – Abn-CBD nie wpływało na poziom glukozy i insuliny we krwi [ 160 ]. Jednakże w innych badaniach związek ten wykazuje potencjał przeciwcukrzycowy poprzez aktywację GPR55 [ 161 , 162 , 163 , 164 ]. Abn-CBD ma również właściwości neuroprotekcyjne, ponieważ zmniejsza objętość zawału równie silnie, jak CBD w mysim modelu udaru [ 53 ]. Podsumowując, zarówno CBD, jak i jego syntetyczny analog Abn-CBD ma właściwości rozszerzające naczynia krwionośne (jednocześnie CBD hamuje działanie wazorelaksacyjne Abn-CBD) i wykazuje potencjalnie korzystne działanie na układ sercowo-naczyniowy, jednak poprzez różne (nawet częściowo przeciwstawne) mechanizmy . Tę pozorną sprzeczność można wytłumaczyć złożonym i wielokierunkowym mechanizmem działania CBD, np. (1) działanie CBD rozszerzające naczynia następuje poprzez bezpośrednią lub pośrednią aktywację różnych receptorów (w zależności od łożyska naczyniowego), w tym CB 1 , TRPV1, EP 4 , IP i PPAR-γ [ 48 , 56 , 106 ]; (2) CBD może działać zarówno jako antagonista, jak i częściowy agonista GPR18 [ 156 ]; oraz (3) CBD bezpośrednio antagonizuje GPR55 [ 11 ], ale może potencjalnie aktywować ten receptor pośrednio poprzez hamowanie degradacji endokannabinoidów [ 27 ].
6. Wnioski
W artykule dokonano przeglądu wpływu kannabidiolu, nieodurzającego składnika konopi indyjskich o szerokim potencjale terapeutycznym i dobrym profilu bezpieczeństwa, na układ sercowo-naczyniowy w warunkach fizjologicznych i patologicznych (podsumowane w:Rysunek 5). CBD może wpływać na układ sercowo-naczyniowy poprzez różne mechanizmy bezpośrednie i pośrednie. Szczegółowe określenie wpływu CBD na układ sercowo-naczyniowy jest istotne ze względu na stale rosnące wykorzystanie tego związku w celach terapeutycznych (w tym samoleczenia) lub rekreacyjnych. Jednakże, z kilkoma wyjątkami, wpływ CBD na układ sercowo-naczyniowy w warunkach fizjologicznych wydaje się znikomy, co potwierdza dobry profil bezpieczeństwa tego kannabinoidu. Z drugiej strony rozważane jest potencjalne zastosowanie CBD w leczeniu zaburzeń sercowo-naczyniowych. W eksperymentalnych stanach patologicznych, takich jak nadciśnienie, choroby serca, udar, niedotlenienie-niedokrwienie noworodków, cukrzyca lub niedokrwienie/uszkodzenie reperfuzyjne wątroby i nerek, ochronne działanie CBD związane z jego działaniem przeciwzapalnym, przeciwutleniającym, przeciwapoptotycznym, naczynioprotekcyjnym, kardioprotekcyjnym lub neuroprotekcyjnym efekty często się ujawniają. Pomimo właściwości rozszerzających naczynia krwionośne, w zwierzęcych modelach nadciśnienia nie wykazano, że CBD wykazuje działanie hipotensyjne. Jednakże związek ten może obniżyć wywołany stresem wzrost ciśnienia krwi zarówno u ludzi, jak i zwierząt. Niemniej jednak należy podkreślić, że prawie nie przeprowadzono badań klinicznych CBD w chorobach układu sercowo-naczyniowego, w związku z czym jego potencjał terapeutyczny nie przekłada się na praktykę kliniczną. Dalsze badania, szczególnie kliniczne, uzasadniają zalecenie stosowania CBD w leczeniu zaburzeń sercowo-naczyniowych.
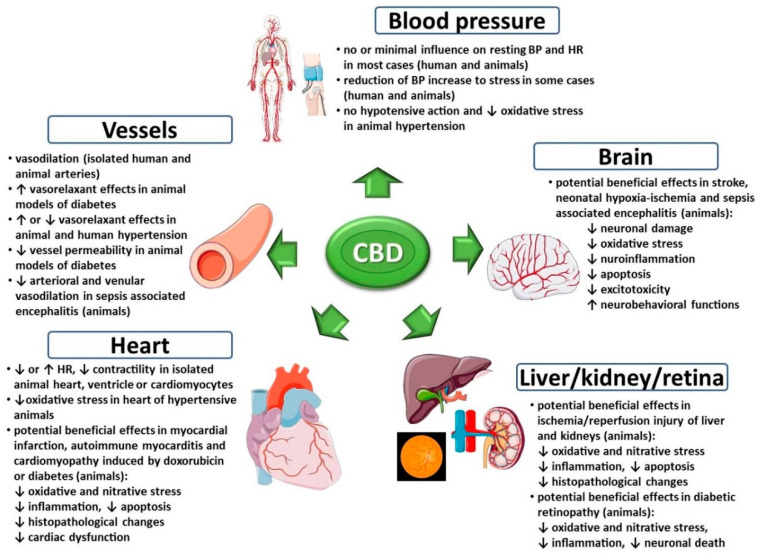
Rysunek 5
Wpływ kannabidiolu (CBD) na układ sercowo-naczyniowy w warunkach fizjologicznych i patologicznych [ 7 , 15 , 23 , 24 , 47 , 48 , 49 , 50 , 51 , 52 , 53 , 54 , 55 , 56 , 57 , 74 , 75 , 76 , 77 , 78 , 79 , 80 , 81 , 82 , 83 , 84 , 85 , 86 , 87 , 88 , 89 , 90 , 91 , 92 , 93 , 94 , 95 , 96 , 97 , 98 , 99 , 100 , 101 , 102 , 103 , 104 , 105 , 106 , 107 , 108 , 109 , 110 , 111 , 112 , 113 , 114 , 115 , 116 , 117 , 118 , 119 , 120 , 121 , 122 , 123 , 124 , 125 , 126 , 127 , 128 , 129 , 130 , 131 , 132 , 133 , 134 , 135 , 136 , 137 , 138 , 139 , 140 , 141 , 142 , 143 , 144 , 145 , 146 , 147 , 148 ] . Skróty: BP: ciśnienie krwi, HR: tętno; figurę tę przygotowano przy użyciu szablonu znajdującego się na stronie internetowej Servier Medical Art.
źródło: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7554803/
