Różne składniki układu endokannabinoidowego (ECS), takie jak receptory kannabinoidowe (CBR), ligandy kannabinoidowe oraz sieć sygnalizacyjna z nią związana, są zaangażowane w kilka stanów związanych z nowotworami, zarówno jako czynniki korzystne, jak i niekorzystne. Niniejszy przegląd analizuje złożone zaangażowanie ECS w podatność na nowotwory, rokowanie i reakcję na leczenie, skupiając się na jego związku z biologią nowotworów w wybranych rodzajach nowotworów złośliwych (piersi, przewodu pokarmowego, ginekologicznych, prostaty, klatki piersiowej, tarczycy, ośrodkowego układu nerwowego i czerniaka). Zmiany w ekspresji i aktywacji receptorów kannabinoidowych, a także ich zdolność do tworzenia odrębnych heteromerów funkcjonalnych, wpływają na potencjał nowotworotwórczy komórek i ich właściwości sygnalizacyjne, prowadząc do farmakologicznie różnych wyników. W związku z tym ten sam składnik ECS może wywierać zarówno efekty ochronne, jak i patogenne w różnych podtypach nowotworów, które często są patologicznie wynikane przez różne czynniki biologiczne. Wykorzystanie kannabinoidów endogennych i egzogennych jako substancji przeciwnowotworowych, a także zakres efektów, jakie mogą wywołać (śmierć komórkowa, regulacja angiogenezy, inwazja lub immunosupresja przeciwnowotworowa), zależy w dużej mierze od rodzaju nowotworu i konkretnego składnika ECS, który jest nimi celem. Choć jest to atrakcyjny cel, wykorzystanie składników ECS w leczeniu przeciwnowotworowym nadal wiąże się z wieloma kwestiami prawno-etycznymi, które wymagają uwagi.
Historycznie kannabinoidy były głównie stosowane jako środki opieki paliatywnej w onkologii. Jednak różne składniki układu endokannabinoidowego (ECS), takie jak receptory kannabinoidowe (CBRs), ligandy kannabinoidowe i ich sieć sygnalizacyjna, są powiązane z kilkoma stanami związanymi z nowotworami, zarówno jako czynniki korzystne, jak i niekorzystne. Ten rozległy zestaw molekuł stanowi atrakcyjny cel farmakologiczny, a jego pełny potencjał nie został jeszcze w pełni wykorzystany. Zrozumienie konkretnych mechanizmów, w jakie składniki ECS mogą regulować cykl komórkowy, proliferację i śmierć komórkową, biorąc pod uwagę ich interakcje z układem immunologicznym, jest konieczne dla rozwinięcia obecnej wiedzy w zakresie podejść terapeutycznych z wykorzystaniem kannabinoidów w leczeniu przeciwnowotworowym. Niniejszy przegląd analizuje złożone zaangażowanie ECS w podatność na nowotwory, rokowanie i reakcję na leczenie, skupiając się na związku z biologią nowotworów w wybranych rodzajach nowotworów złośliwych (piersi, przewodu pokarmowego, ginekologicznych, prostaty, klatki piersiowej, tarczycy, ośrodkowego układu nerwowego i czerniaka).
Jak dotąd w literaturze opisano siedem receptorów reagujących na endogenne i egzogenne ligandy kannabinoidowe u ludzi [1], a mianowicie główne receptory kannabinoidowe 1 i 2 (CB1R, zakodowane przez gen CNR1 [2] i CB2R, zakodowane przez gen CNR2 [3]), a także receptory sprzężone z białkiem G: 18 (receptor glicyny N-arachidonylowej, GPR18 [4]), 55 (GPR55 [5]) i 119 (receptor insulino tropiczny zależny od glukozy, GPR119 [6]) oraz kanały kationowe podrodziny V członków 1 i 2 (TRPV1 [7], TRPV2 [8]). Wszystkie te receptory mogą być przydatnymi celami przeciwnowotworowymi zarówno indywidualnie, jak i w różnych scenariuszach heteromeryzacji. Prosta analiza STRING [9] pokazała, że receptory kannabinoidowe CB1R i CB2R oddziałują bezpośrednio ze sobą, korzystając z kilku platform dowodowych, a także z GPR18, GPR55 i TRPV1 (Rysunek 1a). Dodatkowa analiza skupień rozszerzona do pięciu genów z pierwszej warstwy interakcji pokazała, że GPR119 jest tylko pośrednio połączony z innymi receptorami, podczas gdy TRPV2 wydaje się tworzyć osobną jednostkę sieciową (Rysunek 1b). Rozszerzona sieć jest bogata w interakcje (p-wartość wzbogacenia PPI: 2,39 × 10^−12), co oznacza, że te siedem receptorów w ogólności oddziałuje bardziej, niż można by się spodziewać w przypadku losowego zestawu molekuł o podobnej wielkości, i można je uznać, przynajmniej częściowo, za biologicznie połączoną grupę [9].
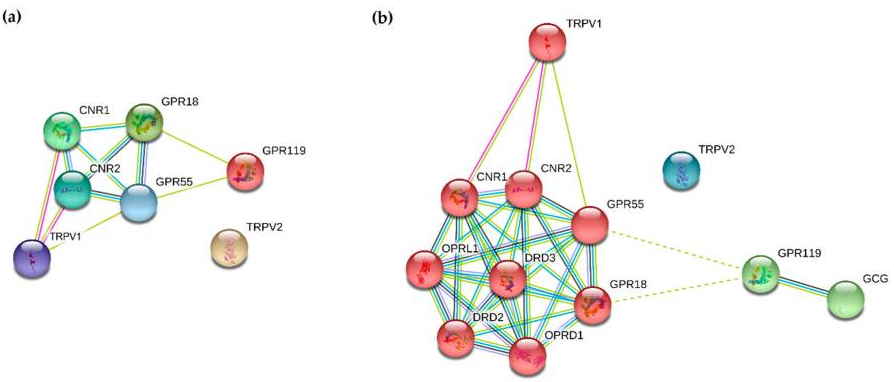
Fig. 1 Jak dotąd w literaturze opisano siedem receptorów reagujących na endogenne i egzogenne ligandy kannabinoidowe u ludzi [1], a mianowicie główne receptory kannabinoidowe 1 i 2 (CB1R, zakodowane przez gen CNR1 [2] i CB2R, zakodowane przez gen CNR2 [3]), a także receptory sprzężone z białkiem G: 18 (receptor glicyny N-arachidonylowej, GPR18 [4]), 55 (GPR55 [5]) i 119 (receptor insulino tropiczny zależny od glukozy, GPR119 [6]) oraz kanały kationowe podrodziny V członków 1 i 2 (TRPV1 [7], TRPV2 [8]). Wszystkie te receptory mogą być przydatnymi celami przeciwnowotworowymi zarówno indywidualnie, jak i w różnych scenariuszach heteromeryzacji. Prosta analiza STRING [9] pokazała, że receptory kannabinoidowe CB1R i CB2R oddziałują bezpośrednio ze sobą, korzystając z kilku platform dowodowych, a także z GPR18, GPR55 i TRPV1 (Rysunek 1a). Dodatkowa analiza skupień rozszerzona do pięciu genów z pierwszej warstwy interakcji pokazała, że GPR119 jest tylko pośrednio połączony z innymi receptorami, podczas gdy TRPV2 wydaje się tworzyć osobną jednostkę sieciową (Rysunek 1b). Rozszerzona sieć jest bogata w interakcje (p-wartość wzbogacenia PPI: 2,39 × 10^−12), co oznacza, że te siedem receptorów w ogólności oddziałuje bardziej, niż można by się spodziewać w przypadku losowego zestawu molekuł o podobnej wielkości, i można je uznać, przynajmniej częściowo, za biologicznie połączoną grupę [9].
